Lewis structura ClO3-ion este trasată pas cu pas în acest tutorial. Electronii de valență totală ai atomilor de oxigen și clor și sarcina negativă sunt considerați a atrage structura ClO3 – lewis. Când am desenat structura lewis, sarcina totală a ionului ar trebui să fie -1.
Lewis Structura de nitrit ion
Acum, am de gând să învețe, cum să atragă această lewis structura de ClO3 – ion pas cu pas.,
Pașii de desen ClO3 – structura lewis
sunt necesari Următorii pași pentru a atrage ClO3 – lewis structura și acestea sunt explicate în detaliu în acest tutorial.
- Găsi numărul total de electroni de valența coji de clor și atomi de oxigen și inclusiv taxa de anioni
- Total de perechi de electroni de valență scoici
- Determinarea centrului atom de clor și oxigen atom
- Pune singuratic perechi pe atomi
- Stabilitate de structura lewis – Verificați stabilitatea și pentru a minimiza taxele pe atomii de conversie singuratic perechi de obligațiuni pentru a obține cea mai bună structură.,desenarea corectă a structurii lewis este importantă pentru a desena structuri de rezonanță ale ClO3 -.
numărul Total de electroni de valența coji de clor și atomi de oxigen și taxa de anioni
Există un singur atom de clor și trei atomi de oxigen în clorat ion. De asemenea, există o încărcare -1 pe ClO3 – ion.
clorul și oxigenul sunt situate la 7 și respectiv 6 grupe în tabelul periodic. Deci clorul are șapte electroni în învelișul său de valență. În atomul de oxigen, există șase electroni în carcasa sa de valență.,hlorine atomi = 7*1 = 7
Există trei atomi de oxigen în ClO3- , prin Urmare,
- Total de electroni de valență dat de atomi de oxigen = 6 *3 = 18
din Cauza -1 responsabil, un alt electroni este adăugat
- din Cauza -1 responsabil, a primit electroni electroni de valență= 1
- Total de electroni de valență = 7 + 18 + 1 = 26
Total de electroni de valență perechi
Total valance perechi de electroni = σ obligațiuni + π obligațiuni + lone perechi la valence scoici
Total de perechi de electroni sunt determinate prin împărțirea numărului total de electroni de valență de două., Pentru, ClO3 – există 26 de electroni de valență, deci perechile totale de electroni sunt 13.
Centru atom de ClO3 – ion
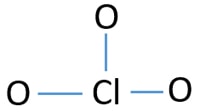
Pentru a fi în centrul atomului, capacitatea de a avea o mai mare valance este important. Clorul poate prezenta valență 7. Dar, valența maximă a oxigenului este 2. Prin urmare, clorul are mai multe șanse să fie atomul central (vezi figura). Deci, acum putem construi o schiță de ClO3-ion.
Schiță de ClO3 – ion
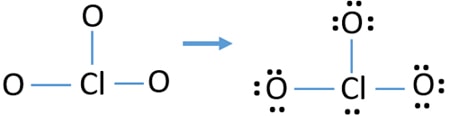
Singuratic perechi pe atomi
- Există deja trei Cl-O obligațiuni în schiță., Prin urmare, doar zece perechi de electroni de valență rămân pentru a atrage restul de ioni.
- următorul pas este, marcarea celor zece perechi de electroni de valență pe atomii externi (atomi de oxigen) ca perechi singure. Un atom de oxigen va lua trei perechi singuratice după regula octală (atomii de oxigen nu pot păstra mai mult de opt electroni în cochilii lor de valență). Prin urmare, nouă perechi de electroni sunt marcate pe trei atomi de oxigen. Acum, rămâne o pereche de electroni (10-9).
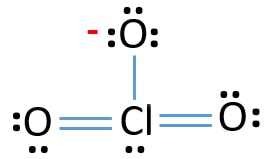
- apoi, perechea de electroni rămasă este marcată pe atomul de clor.,
Verificați stabilitatea trase structura de ClO3 – ion și de a reduce taxele pe atomii de conversie singuratic perechi de obligațiuni
Verifica tarifele la atomi și marcați-le ca mai jos. Taxele sunt importante pentru a decide cea mai bună structură lewis a ionului.

trase structura pentru ClO3 – nu este o structură stabilă, deoarece atomi de oxigen și atomi de clor au taxe. De asemenea, atunci când sarcina unui atom este mare, acea structură devine mai instabilă. Când o moleculă sau un ion are atât de multe sarcini asupra atomilor, acea structură nu este stabilă.,acum, ar trebui să încercăm să minimizăm încărcările prin conversia perechilor sau perechilor care există pe atomii de oxigen în legături. Deci convertim o pereche de atomi de oxigen ca o legătură Cl-O ca în figura de mai jos.
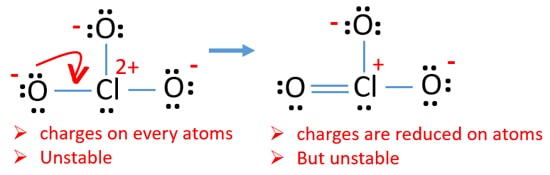
acum există o dublă legătură între clor și un atom de oxigen. Există, de asemenea, două legături unice (Cl-o) cu atomul de clor și alți doi atomi de oxigen.dar, există încă taxe pe atomi. Dacă este posibil, ar trebui să reducem taxele în plus. O altă pereche singuratică pe un alt atom de oxigen este transferată ca o legătură Cl-O.,
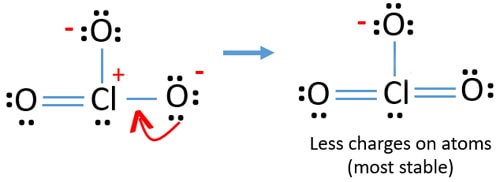
acum, există doisprezece electroni în jurul atomului de clor. Acest lucru este acceptabil deoarece clorul poate păstra mai mult de opt electroni clorul are orbite 3D neumplute.
în noua structură, sarcinile atomilor sunt reduse în plus. Acum nu există nici o sarcină pe doi atomi de oxigen. De asemenea, încărcarea atomului de clor este redusă la zero. Acum înțelegeți această structură a ClO3 – este mai stabilă decât structura anterioară datorită încărcărilor mai mici asupra atomilor.,
ClO3 – structura Lewis

Întrebări
Cere chimie întrebări și a găsi răspunsuri
Ce se forma în jurul atom de clor în ClO3 – ion?
există trei legături σ și o singură pereche în jurul atomului de clor în structura Lewis a ClO3 – ion. Prin urmare, forma ionului este piramidală trigonală.
câte încărcături în atomi de structură de Ion clorat lewis?
doar un atom de oxigen are o încărcare -1. Toți ceilalți atomi nu au încărcături. Prin urmare, încărcarea totală a ionului de clorat este de -1.,
clo3 structura lewis
nu Există nici o moleculă sau ion ca ClO3. Formula corectă a ionului clorat este ClO3 -.