Lewis structuur van ClO3-ion wordt stap voor stap getekend in deze tutorial. Totale valentie-elektronen van zuurstof – en chlooratomen en negatieve lading worden beschouwd als de ClO3 – lewis-structuur te trekken. Toen we de lewis structuur tekenden, zou de totale lading van het ion -1 moeten zijn.
Lewis structuur van nitriet ion
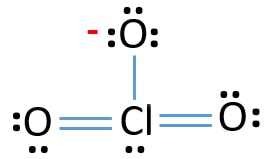
nu gaan we leren hoe we deze Lewis structuur van ClO3 – ion stap voor stap kunnen tekenen.,
stappen voor het tekenen van ClO3-lewis structuur
volgende stappen zijn vereist om ClO3 – lewis structuur te tekenen en ze worden in detail uitgelegd in deze tutorial.
- zoek het totale aantal elektronen van de valantieschillen van chloor – en zuurstofatomen en inclusief lading van het anion
- totale elektronenparen in valentieschillen
- Bepaal het middenatoom uit chloor – en zuurstofatoom
- zet eenzame paren op atomen
- stabiliteit van lewis structuur-controleer de stabiliteit en minimaliseer de ladingen op atomen door eenzame paren om te zetten in bindingen om de beste structuur te verkrijgen.,
Drawing correcte lewis structuur is belangrijk om resonantie structuren van ClO3-tekenen.
totaal aantal elektronen van de valantieschillen van chloor – en zuurstofatomen en lading van het anion
het chloraation bevat één chlooratoom en drie zuurstofatomen. Ook is er een -1 lading op het ClO3-ion.
chloor en zuurstof bevinden zich in respectievelijk 7 en 6 groepen in het periodiek systeem. Chloor heeft dus zeven elektronen in zijn valentieschil. In het zuurstofatoom zitten zes elektronen in zijn valentieschil.,hlorine atomen = 7*1 = 7
Er zijn drie zuurstof atomen in ClO3 , Daarom is
- Totaal valence elektronen gegeven door zuurstof atomen = 6 *3 = 18
Wegens -1 lading, een andere elektronen is toegevoegd
- Door -1 lading, ontvangen elektronen naar valence elektronen= 1
- Totaal valence elektronen = 7 + 18 + 1 = 26
Totaal valence elektronen paren
Totaal volant elektronen paren = σ obligaties + π obligaties + eenzame paren in valence-shells
Totaal elektron paren worden bepaald door de verdeling van het totaal aantal valentie elektronen per twee., Voor, ClO3-er zijn 26 valentie-elektronen, dus de totale paren van elektronen zijn 13.
centrum-atoom van ClO3-ion
om het centrum-atoom te zijn, is het vermogen om een grotere valantie te hebben belangrijk. Chloor kan valentie 7 tonen. Maar zuurstof ‘ s maximale valentie is 2. Daardoor heeft chloor meer kans om het centrum atoom te zijn (zie figuur). Nu kunnen we een schets maken van ClO3-ion.
schets van ClO3-ion
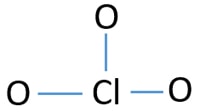
eenzame paren op atomen
- Er zijn al drie Cl-O-bindingen in de schets., Daarom zijn er nog maar tien valentieelektronenparen over om de rest van het ion te tekenen.
- de volgende stap is het markeren van die tien valentie-elektronenparen op externe atomen (zuurstofatomen) als eenzame paren. Eén zuurstofatoom neemt drie eenzame paren volgens de octale regel (zuurstofatomen kunnen niet meer dan acht elektronen in hun valentieschelp houden). Daarom zijn negen elektronenparen gemarkeerd op drie zuurstofatomen. Nu blijft er één elektronenpaar (10-9) over.
- dan wordt het resterende elektronenpaar gemarkeerd op chlooratoom.,
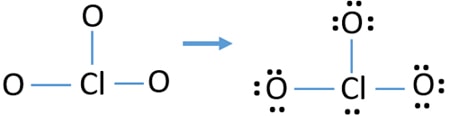
controleer de stabiliteit van de getekende structuur van ClO3 – ion en verminder de ladingen op atomen door eenzame paren om te zetten in bindingen
controleer de ladingen op atomen en markeer ze zoals hieronder. Ladingen zijn belangrijk om de beste lewis structuur van het ion te bepalen.

de getekende structuur voor ClO3 – is geen stabiele structuur omdat zuurstofatomen en chlooratomen ladingen hebben. Ook wanneer de lading van een atoom groot is, wordt die structuur onstabieler. Wanneer een molecuul of ion zoveel ladingen op atomen heeft, is die structuur niet stabiel.,
nu moeten we proberen om ladingen te minimaliseren door eenzame paar of paren die bestaan op zuurstofatomen om te zetten in bindingen. Dus zetten we één enkel paar van één zuurstofatoom om als een Cl-O binding zoals in de volgende figuur.
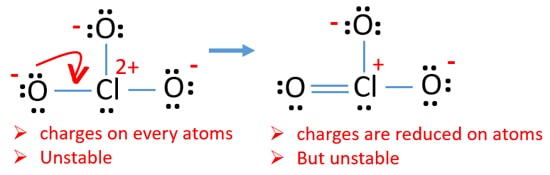
nu is er een dubbele binding tussen chloor en één zuurstofatoom. Er zijn ook twee enkelvoudige bindingen (Cl-O) met chlooratoom en andere twee zuurstofatomen.
maar er zijn nog steeds ladingen op atomen. Indien mogelijk moeten we bovendien de kosten verlagen. Een ander eenzame paar op een ander zuurstofatoom wordt overgedragen als een Cl-O binding.,
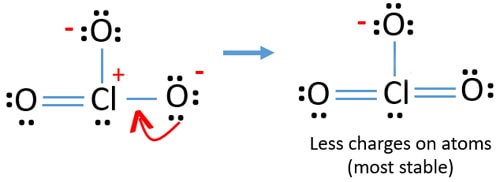
nu zijn er twaalf elektronen rond chlooratoom. Dit is aanvaardbaar omdat chloor meer dan acht elektronen kan houden chloor heeft ongevulde 3D banen.
in een nieuwe structuur worden bovendien de ladingen van atomen verminderd. Nu is er geen lading op twee zuurstofatomen. Ook wordt de lading van chlooratoom gereduceerd tot nul. Nu begrijp je dat deze structuur van ClO3 stabieler is dan de vorige structuur door minder ladingen op atomen.,
ClO3 – Lewis structuur

vragen
stel uw scheikundige vragen en vind de antwoorden
Wat is de vorm rond chlooratoom in ClO3-ion?
Er zijn drie σ-bindingen en één enkel paar rond chlooratoom in de lewis-structuur van ClO3-ion. Daarom is de vorm van ion trigonaal piramidaal.
hoeveel ladingen in atomen van chloraat-ion lewis structuur?
slechts één zuurstofatoom heeft een -1 lading. Alle andere atomen hebben geen ladingen. Daarom is de totale lading van chloraation -1.,
clo3 lewis structuur
Er is geen molecuul of ion als ClO3. De juiste formule van chloraation is ClO3-.