Lewis structure of ClO3 – ion è disegnato passo dopo passo in questo tutorial. Gli elettroni di valenza totale degli atomi di ossigeno e cloro e la carica negativa sono considerati per disegnare la struttura di ClO3-lewis. Quando abbiamo disegnato la struttura di Lewis, la carica complessiva dello ion dovrebbe essere -1.
Lewis Structure of nitrite ion
Ora, stiamo per imparare, come disegnare questa struttura lewis di ClO3 – ion passo dopo passo.,
Passi per disegnare la struttura ClO3 – lewis
I passi seguenti sono necessari per disegnare la struttura ClO3 – lewis e sono spiegati in dettaglio in questo tutorial.
- Trova il numero totale di elettroni di valance gusci di cloro e atomi di ossigeno e compreso di carica dell’anione
- Totale coppie di elettroni di valenza di conchiglie
- Determinare il centro atomo di cloro e di atomo di ossigeno
- Mettere lone pairs su atomi
- Stabilità di struttura di lewis – Verificare la stabilità e ridurre al minimo le spese su atomi convertendo lone pairs di obbligazioni per ottenere la migliore struttura.,
Disegnare una corretta struttura di lewis è importante per disegnare strutture di risonanza di ClO3-.
Numero totale di elettroni dei gusci di valance di atomi di cloro e ossigeno e carica dell’anione
Ci sono un atomo di cloro e tre atomi di ossigeno nello chlor clorato. Inoltre c’è una carica -1 sul ClO3 – ion.
Il cloro e l’ossigeno si trovano rispettivamente a 7 e 6 gruppi nella tavola periodica. Quindi il cloro ha sette elettroni nel suo guscio di valenza. Nell’atomo di ossigeno, ci sono sei elettroni nel suo guscio di valenza.,hlorine atomi = 7*1 = 7
Ci sono tre atomi di ossigeno in ClO3- , Quindi
- Totale di elettroni di valenza dato da atomi di ossigeno = 6 *3 = 18
a Causa di -1 carica, un altro elettroni è aggiunto
- a Causa di -1 carica, ricevuto elettroni elettroni di valenza= 1
- Totale di elettroni di valenza = 7 + 18 + 1 = 26
Totale di elettroni di valenza di coppie
Totale valance coppie di elettroni = σ obbligazioni + π obbligazioni + lone pairs a valence conchiglie
Totale coppie di elettroni sono determinate dividendo il numero totale di elettroni di valenza per due., Per, ClO3 – ci sono 26 elettroni di valenza, quindi le coppie totali di elettroni sono 13.
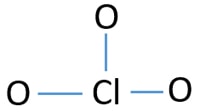
Atomo centrale di ClO3-ion
Per essere l’atomo centrale, la capacità di avere una maggiore mantovana è importante. Il cloro può mostrare valenza 7. Ma la valenza massima dell’ossigeno è 2. Quindi il cloro ha più possibilità di essere l’atomo centrale (Vedi la figura). Quindi, ora possiamo costruire uno schizzo di ClO3-ion.
Schizzo di ClO3 – ion
Coppie solitarie su atomi
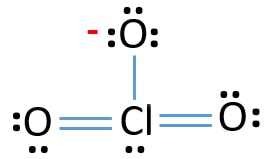
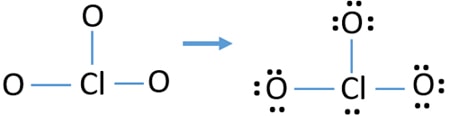
- Ci sono già tre legami Cl-O nello schizzo., Pertanto rimangono solo dieci coppie di elettroni di valenza per disegnare il resto dello ion.
- Il passo successivo è contrassegnare quelle dieci coppie di elettroni di valenza su atomi esterni (atomi di ossigeno) come coppie solitarie. Un atomo di ossigeno prenderà tre coppie solitarie seguendo la regola ottale (gli atomi di ossigeno non possono tenere più di otto elettroni nei loro gusci di valenza). Pertanto, nove coppie di elettroni sono contrassegnate su tre atomi di ossigeno. Ora, rimane una coppia di elettroni (10-9).
- Quindi, la coppia di elettroni rimanente è contrassegnata sull’atomo di cloro.,
Controlla la stabilità della struttura disegnata di ClO3 – ion e riduci le cariche sugli atomi convertendo coppie solitarie in legami
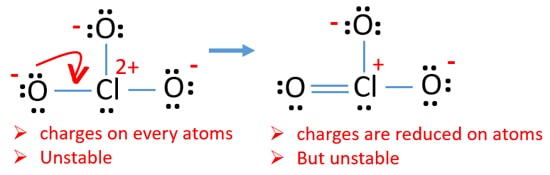
Controlla le cariche sugli atomi e contrassegnale come di seguito. Le cariche sono importanti per decidere la migliore struttura di lewis dello ion.

La struttura disegnata per ClO3 – non è una struttura stabile perché gli atomi di ossigeno e gli atomi di cloro hanno cariche. Inoltre, quando la carica di un atomo è grande, quella struttura diventa più instabile. Quando una molecola o uno ion ha così tante cariche sugli atomi, quella struttura non è stabile.,
Ora, dovremmo cercare di ridurre al minimo le cariche convertendo coppie solitarie o coppie che esistono sugli atomi di ossigeno in legami. Quindi convertiamo una coppia solitaria di un atomo di ossigeno come legame Cl-O come nella figura seguente.
Ora c’è un doppio legame tra cloro e un atomo di ossigeno. Ci sono anche due singoli legami (Cl-O) con atomo di cloro e altri due atomi di ossigeno.
Ma ci sono ancora cariche sugli atomi. Se possibile, dovremmo ridurre ulteriormente le tariffe. Un’altra coppia solitaria su un altro atomo di ossigeno viene trasferita come legame Cl-O.,
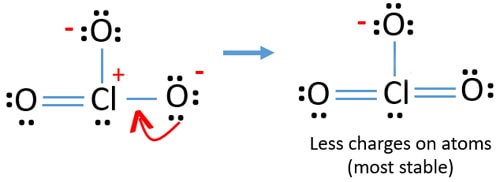
Ora, ci sono dodici elettroni intorno atomo di cloro. Questo è accettabile perché il cloro può mantenere più di otto elettroni cloro ha vacanti orbite 3d.
Nella nuova struttura, le cariche di atomi sono ridotte ulteriormente. Ora non c’è alcuna carica su due atomi di ossigeno. Inoltre, la carica dell’atomo di cloro è ridotta a zero. Ora capisci questa struttura di ClO3-è più stabile della struttura precedente a causa di meno cariche sugli atomi.,
ClO3 – Lewis structure

Domande
Fai le tue domande di chimica e trova le risposte
Qual è la forma intorno all’atomo di cloro in ClO3 – ion?
Ci sono tre legami σ e una coppia solitaria attorno all’atomo di cloro nella struttura di lewis dello ClO ClO3. Pertanto, la forma dello ion è piramidale trigonale.
Quante cariche in atomi di clorato ion lewis struttura?
Solo un atomo di ossigeno ha una carica -1. Tutti gli altri atomi non hanno cariche. Pertanto, la carica complessiva dello chlor clorato è -1.,
clo3 lewis structure
Non c’è molecola o ion come ClO3. La formula corretta dello chlor clorato è ClO3 -.