Lewis struktura ClO3 – ion je vypracován krok za krokem v tomto návodu. Celkové valenční elektrony atomů kyslíku a chloru a záporný náboj jsou považovány za kreslení struktury ClO3 – lewis. Když jsme nakreslili Lewisovu strukturu, celkový náboj iontu by měl být -1.
Lewis Struktura dusitanů ion
Nyní, se budeme učit, jak k tomu této lewis struktura ClO3 – ion krok za krokem.,
Kroky kreslení ClO3 – lewis struktura
Tyto kroky jsou požadovány ClO3 – lewis struktura a jsou podrobně vysvětleny v tomto návodu.
- Najít celkový počet elektronů bočního krytu náboje chloru a kyslíku atomy a včetně poplatku z anion
- Celkem párů elektronů ve valenční vrstvy
- Určit, centrum atom z chloru a atom kyslíku
- Dát osamělé páry na atomech,
- Stabilita lewis struktura – Zkontrolujte stabilitu a minimalizovat poplatky na atomy převedením osamělé páry na dluhopisy, jak získat nejlepší strukturu.,
kresba správná Lewisova struktura je důležitá pro kreslení rezonančních struktur ClO3-.
Celkový počet elektronů bočního krytu náboje chloru a kyslíku atomy a starosti anion
Existuje jeden atom chlóru a tři atomy kyslíku ve draselný ion. Na ClO3 – ion je také náboj -1.
chlor a kyslík jsou umístěny v 7 a 6 skupinách v periodické tabulce. Takže chlor má ve své valenční skořápce sedm elektronů. V atomu kyslíku je ve své valenční skořápce šest elektronů.,hlorine atomů = 7*1 = 7
k Dispozici jsou tři atomy kyslíku v ClO3- , Proto
- Celkem sedm valenčních elektronů dáno tím, že atomy kyslíku = 6 *3 = 18
Vzhledem k -1 poplatek, další elektrony je přidán
- Vzhledem k -1 poplatku, obdržel elektrony valenční elektrony= 1
- Celkem sedm valenčních elektronů = 7 + 18 + 1 = 26
Celkem sedm valenčních elektronů páry
Celkem záclonka elektrony párů = σ dluhopisy + π dluhopisy + osamělé páry ve valenční vrstvy,
Celkové elektronové páry jsou určeny vydělením počtu celkem sedm valenčních elektronů o dva., Pro, ClO3 – existuje 26 valenčních elektronů, takže celkové páry elektronů jsou 13.
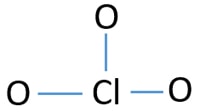
středový atom ClO3-ion
aby byl středovým atomem, je důležitá schopnost mít větší valanci. Chlor může ukázat valence 7. Maximální valence kyslíku je však 2. Proto má chlor větší šanci být středovým atomem (viz obrázek). Takže teď můžeme vytvořit náčrt ClO3-ion.
Skica ClO3 – ion
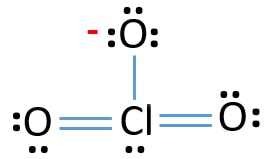
Osamělé páry na atomech
- tři už jsou Cl-O vazby ve skice., Zbývá tedy pouze deset párů valenčních elektronů, které nakreslí zbytek iontu.
- dalším krokem je označení těchto deseti párů valenčních elektronů na vnějších atomech (atomy kyslíku) jako osamělé páry. Jeden atom kyslíku bude mít tři osamělé páry podle osmičkového pravidla (atomy kyslíku nemohou udržet více než osm elektronů ve svých valenčních skořápkách). Proto je devět elektronových párů vyznačeno na třech atomech kyslíku. Nyní zbývá jeden pár elektronů (10-9).
- zbývající elektronový pár je pak označen na atomu chloru.,
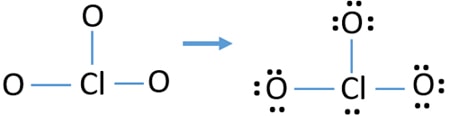
Kontrola stability byly strukturu ClO3 – ion a snížit náklady na atomy převedením osamělé páry na dluhopisy
Zkontrolujte, zda poplatky na atomy a označit je jako níže. Poplatky jsou důležité pro rozhodnutí o nejlepší Lewisově struktuře iontu.

nakreslené struktury pro ClO3 – není stabilní strukturu, protože atomy kyslíku a atomy chloru mají poplatky. Také, když je náboj atomu velký, tato struktura se stává nestabilní. Když molekula nebo iont má tolik nábojů na atomy, tato struktura není stabilní.,
nyní bychom se měli pokusit minimalizovat poplatky přeměnou osamělého páru nebo párů, které existují na atomech kyslíku na vazby. Takže převádíme jeden osamělý pár jednoho atomu kyslíku jako vazbu Cl – o jako na následujícím obrázku.
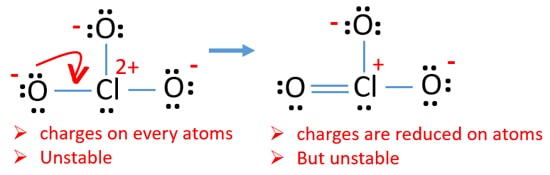
nyní existuje dvojitá vazba mezi chlorem a jedním atomem kyslíku. Existují také dvě jednotlivé vazby (Cl-o) s atomem chloru a dalšími dvěma atomy kyslíku.
ale stále existují náboje na atomech. Pokud je to možné, měli bychom snížit poplatky navíc. Další osamělý pár na jiném atomu kyslíku se přenáší jako Cl-o vazba.,
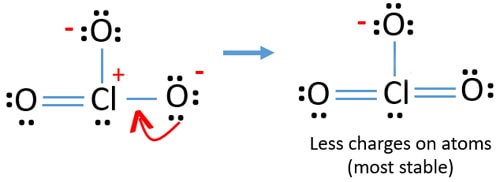
nyní je kolem atomu chloru dvanáct elektronů. To je přijatelné, protože chlor může udržet více než osm elektronů chlor má nevyplněné 3D oběžné dráhy.
v nové struktuře se dále snižují náboje atomů. Nyní neexistuje žádný náboj na dvou atomech kyslíku. Také náboj atomu chloru je snížen na nulu. Nyní chápete tuto strukturu ClO3-je stabilnější než předchozí struktura kvůli menším nábojům na atomech.,
ClO3 – Lewis struktura

Otázky
Zeptejte se svého chemie otázky a najít odpovědi
Jaký je tvar kolem atom chloru v ClO3 – ion?
v Lewisově struktuře ClO3-ion jsou tři σ vazby a jeden osamělý pár kolem atomu chloru. Proto je tvar iontu trigonální pyramidální.
kolik nábojů v atomech chlorátově iontové Lewisovy struktury?
pouze jeden atom kyslíku má náboj -1. Všechny ostatní atomy nemají náboje. Proto je celkový náboj chlorátového iontu -1.,
clo3 Lewisova struktura
neexistuje molekula ani iont jako ClO3. Správný vzorec chlorečnanu je ClO3 -.