Lewis struktur von ClO3-ion ist gezeichnet schritt für schritt in diesem tutorial. Es wird angenommen, dass Gesamtvalenzelektronen von Sauerstoff – und Chloratomen und negative Ladung die ClO3-Lewis-Struktur zeichnen. Als wir die Lewis-Struktur zeichneten, sollte die Gesamtladung des Ions -1 sein.
Lewis Struktur von Nitrit ion
Nun werden wir lernen, wie man diese lewis Struktur von ClO3 – ion Schritt für Schritt zeichnet.,
Schritte zum Zeichnen der ClO3-Lewis-Struktur
Zum Zeichnen der ClO3 – lewis-Struktur sind folgende Schritte erforderlich, die in diesem Tutorial ausführlich erläutert werden.
- Finden Sie die Gesamtzahl der Elektronen der Valanzschalen von Chlor – und Sauerstoffatomen und einschließlich der Ladung des Anions
- Gesamtelektronenpaare in Valenzschalen
- Bestimmen Sie das Zentrumsatom aus Chlor – und Sauerstoffatom
- Setzen Sie Einzelpaare auf Atome
- Stabilität der Lewis-Struktur-Überprüfen Sie die Stabilität und minimieren Sie die Ladungen auf Atomen, indem Sie Einzelpaare in Bindungen umwandeln, um die beste Struktur zu erhalten.,
Das Zeichnen der korrekten Lewis-Struktur ist wichtig, um Resonanzstrukturen von ClO3-zu zeichnen.
Gesamtzahl der Elektronen der Valanzschalen von Chlor – und Sauerstoffatomen und Ladung des Anions
Im Chlorat-Ion befinden sich ein Chloratom und drei Sauerstoffatome. Außerdem gibt es eine -1 Ladung auf dem ClO3 – Ion.
Chlor und Sauerstoff befinden sich in 7 bzw. 6 Gruppen im Periodensystem. Chlor hat also sieben Elektronen in seiner Valenzschale. Im Sauerstoffatom befinden sich sechs Elektronen in seiner Valenzschale.,Hlorinatome = 7*1 = 7
Es gibt drei Sauerstoffatome in ClO3- , Daher
- Gesamtvalenzelektronen gegeben durch Sauerstoffatome = 6 *3 = 18
Aufgrund -1 Ladung wird ein weiteres Elektron hinzugefügt
- Aufgrund -1 Ladung, empfangene Elektronen zu Valenzelektronen= 1
- Gesamtvalenzelektronen = 7 + 18 + 1 = 26
Gesamtvalenzelektronenpaare
Gesamtvalanzelektronenpaare = σ-Bindungen + π-Bindungen + Einzelpaare bei Valenzschalen
Die Gesamtelektronenpaare werden bestimmt, indem die Anzahl der Gesamtvalenzelektronen durch zwei dividiert wird., Für ClO3 – es gibt 26 Valenzelektronen, also sind Gesamtelektronenpaare 13.
Mittelatom des ClO3-Ions
Um das Mittelatom zu sein, ist die Fähigkeit wichtig, eine größere Wertigkeit zu haben. Chlor kann Valenz 7 zeigen. Aber Sauerstoffs maximale Wertigkeit ist 2. Daher hat Chlor mehr Chancen, das Mittelatom zu sein (siehe Abbildung). Jetzt können wir eine Skizze von ClO3-Ion erstellen.
Skizze von ClO3-ion
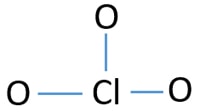
Einzelpaare auf Atomen
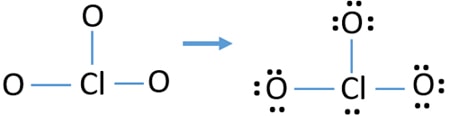
- Die Skizze enthält bereits drei Cl-O-Bindungen., Daher sind nur noch zehn Valenzelektronenpaare übrig, um den Rest des Ions zu zeichnen.
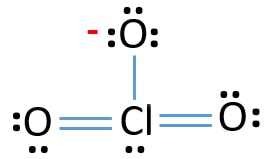
- Der nächste Schritt besteht darin, diese zehn Valenzelektronenpaare an äußeren Atomen (Sauerstoffatomen) als einsame Paare zu markieren. Ein Sauerstoffatom benötigt nach der Oktalregel drei einsame Paare (Sauerstoffatome dürfen nicht mehr als acht Elektronen in ihren Valenzschalen behalten). Daher sind neun Elektronenpaare auf drei Sauerstoffatomen markiert. Jetzt ist ein Elektronen-Paar (10-9) übrig.
- Dann wird das verbleibende Elektronenpaar auf dem Atom markiert.,
Überprüfen Sie die Stabilität der Struktur von ClO3 – Ionen und reduzieren Sie Ladungen an Atomen, indem Sie einzelne Paare in Bindungen umwandeln
Überprüfen Sie Ladungen an Atomen und markieren Sie sie wie folgt. Ladungen sind wichtig, um die beste Lewis-Struktur des Ions zu bestimmen.

Die gezeichnete Struktur für ClO3 – ist keine stabile Struktur, da Sauerstoffatome und Chloratome Ladungen haben. Auch wenn die Ladung eines Atoms groß ist, wird diese Struktur instabiler. Wenn ein Molekül oder Ion so viele Ladungen auf Atomen hat, ist diese Struktur nicht stabil.,
Jetzt sollten wir versuchen, Ladungen zu minimieren, indem wir einzelne Paare oder Paare, die auf Sauerstoffatomen existieren, in Bindungen umwandeln. Wir wandeln also ein einzelnes Paar eines Sauerstoffatoms als Cl-O-Bindung um, wie in der folgenden Abbildung dargestellt.
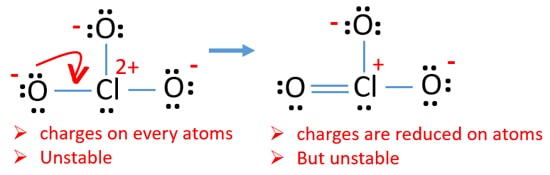
Jetzt gibt es eine Doppelbindung zwischen Chlor und einem Sauerstoffatom. Es gibt auch zwei einzelne Bindungen (Cl-O) mit Chloratom und anderen zwei Sauerstoffatomen.
Aber es gibt immer noch Ladungen auf Atomen. Wenn möglich, sollten wir die Gebühren weiter senken. Ein anderes einsames Paar auf einem anderen Sauerstoffatom wird als Cl-O-Bindung übertragen.,
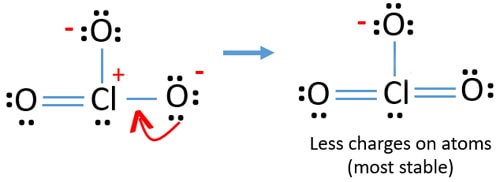
Jetzt gibt es zwölf Elektronen um Chlor-atom. Dies ist akzeptabel, da Chlor mehr als acht Elektronen halten kann Chlor hat ungefüllte 3D-Bahnen.
In der neuen Struktur werden Ladungen von Atomen weiter reduziert. Jetzt gibt es keine Ladung mehr auf zwei Sauerstoffatome. Auch die Ladung des Chloratoms wird auf Null reduziert. Jetzt verstehen Sie diese Struktur von ClO3-ist stabiler als vorherige Struktur aufgrund weniger Ladungen auf Atomen.,
ClO3 – Ionenstruktur
Fragen
Stellen Sie Ihre Chemie Fragen und finden Sie die Antworten
Was ist die Form um Chloratom in ClO3-ion?
Es gibt drei σ-Bindungen und ein einsames Paar um das Chloratom in der Struktur von ClO3-Ionen. Daher ist die Form des Ions trigonal pyramidal.
Wie viele Ladungen in Atomen der Chlorat-Ionen-Lewis-Struktur?
Nur ein Sauerstoffatom hat eine -1 Ladung. Alle anderen Atome haben keine Ladungen. Daher ist die Gesamtladung des Chlorat-Ions -1.,
clo3 lewis Struktur
Es gibt kein Molekül oder Ion als ClO3. Die richtige Formel von Chlorat Ion ist ClO3 -.