La estructura de Lewis de ClO3-ion se dibuja paso a paso en este tutorial. Se considera que los electrones de Valencia Total de los átomos de oxígeno y cloro y la carga negativa dibujan la estructura ClO3 – lewis. Cuando dibujamos la estructura de lewis, la carga total del ion debería ser -1.
Estructura de Lewis del ion nitrito
Ahora, vamos a aprender, cómo dibujar la estructura de lewis de ClO3 – ion paso por paso.,
pasos para dibujar la estructura ClO3 – lewis
Los siguientes pasos son necesarios para dibujar la estructura ClO3 – lewis y se explican en detalle en este tutorial.
- encontrar el número total de electrones de las capas de cenefa de átomos de cloro y oxígeno e incluyendo la carga del anión
- pares Totales de electrones en capas de Valencia
- Determinar el átomo central a partir del átomo de cloro y oxígeno
- poner pares solitarios en átomos
- estabilidad de la estructura de lewis – Compruebe la estabilidad y minimice las cargas en los átomos convirtiendo pares solitarios en enlaces para obtener la mejor estructura.,
dibujar la estructura correcta de lewis es importante para dibujar estructuras de resonancia de ClO3 -.
número Total de electrones de las capas de cenefa de átomos de cloro y oxígeno y carga del anión
hay un átomo de cloro y tres átomos de oxígeno en el ion clorato. También hay una carga -1 en el ion ClO3.
El cloro y el oxígeno se encuentran en 7 y 6 grupos respectivamente en la Tabla periódica. Así que el cloro tiene siete electrones en su envoltura de Valencia. En el átomo de oxígeno, hay seis electrones en su envoltura de Valencia.,hlorine atoms = 7*1 = 7
Hay tres átomos de oxígeno en ClO3 -, por lo tanto
- electrones de Valencia totales dados por átomos de oxígeno = 6 *3 = 18
debido a la carga -1, se agrega otro electrones
- Debido a la carga -1, electrones recibidos a electrones de Valencia = 1
- Total electrones de Valencia= 7 + 18 + 1 = 26
pares Totales de electrones de Valencia
pares Totales de electrones de Valencia = enlaces σ + enlaces π + pares solitarios en capas de Valencia
los pares Totales de electrones se determinan dividiendo el número total de electrones de Valencia por dos., Para, ClO3 – hay 26 electrones de Valencia, por lo que los pares Totales de electrones son 13.
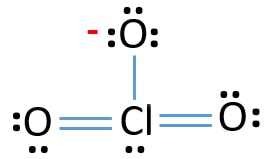
átomo central de ion ClO3
para ser el átomo central, la capacidad de tener una cenefa mayor es importante. El cloro puede mostrar Valencia 7. Pero, Valencia máxima de oxígeno es 2. Por lo tanto, el cloro tiene más posibilidades de ser el átomo central (ver la figura). Entonces, ahora podemos construir un bosquejo de ClO3-ion.
CROQUIS DE ClO3 – ion
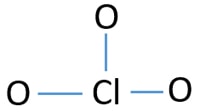
pares solitarios en átomos
- Ya hay tres enlaces Cl-O en el CROQUIS., Por lo tanto, solo quedan diez pares de electrones de Valencia para dibujar el resto del ion.
- El siguiente paso es marcar esos diez pares de electrones de Valencia en átomos externos (átomos de oxígeno) como pares solitarios. Un átomo de oxígeno tomará tres pares solitarios siguiendo la regla octal (los átomos de oxígeno no pueden mantener más de ocho electrones en sus capas de Valencia). Por lo tanto, nueve pares de electrones están marcados en tres átomos de oxígeno. Ahora, queda un par de electrones (10-9).
- Entonces, el par de electrones restante se marca en el átomo de cloro.,
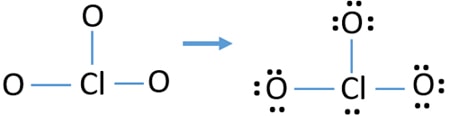
Compruebe la estabilidad de la estructura dibujada del ion ClO3 y reduzca las cargas en los átomos convirtiendo pares solitarios en enlaces
Compruebe las cargas en los átomos y márquelas como se muestra a continuación. Las cargas son importantes para decidir la mejor estructura de lewis del ion.

La estructura dibujada para ClO3-no es una estructura estable porque los átomos de oxígeno y los átomos de cloro tienen cargas. Además, cuando la carga de un átomo es grande, esa estructura se vuelve más inestable. Cuando una molécula o ion tiene tantas cargas en los átomos, esa estructura no es estable.,
ahora, debemos tratar de minimizar las cargas convirtiendo par solitario o pares que existen en átomos de oxígeno en enlaces. Así que convertimos un par solitario de un átomo de oxígeno como un enlace Cl-O como en la siguiente figura.
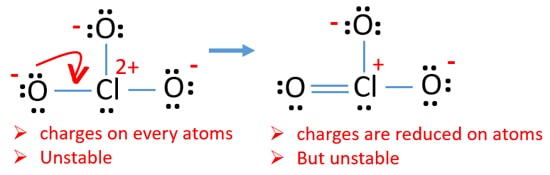
Ahora hay un doble enlace entre el cloro y un átomo de oxígeno. También hay dos enlaces simples (Cl-O) con el átomo de cloro y otros dos átomos de oxígeno.
pero, todavía hay cargas en los átomos. Si es posible, también deberíamos reducir las tasas. Otro par solitario en otro átomo de oxígeno se transfiere como un enlace Cl-O.,
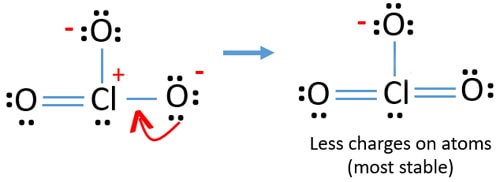
ahora, hay doce electrones alrededor del átomo de cloro. Esto es aceptable porque el cloro puede mantener más de ocho electrones el cloro tiene órbitas 3D sin llenar.
en la nueva estructura, las cargas de los átomos se reducen aún más. Ahora no hay ninguna carga en dos átomos de oxígeno. Además, la carga del átomo de cloro se reduce a cero. Ahora usted entiende esta estructura de ClO3-es más estable que la estructura anterior debido a menos cargas en los átomos.,
ClO3 – Lewis structure

Questions
Haga sus preguntas de química y encuentre las respuestas
¿Cuál es la forma alrededor del átomo de cloro en ClO3 – ion?
hay tres enlaces σ y un par solitario alrededor del átomo de cloro en la estructura de lewis del ion ClO3. Por lo tanto, la forma del ion es piramidal trigonal.
¿cuántas cargas en átomos de clorato ion estructura de lewis?
solo un átomo de oxígeno tiene una carga de -1. Todos los demás átomos no tienen cargas. Por lo tanto, la carga total del ion clorato es -1.,
clo3 estructura de lewis
no hay molécula o ion como ClO3. La fórmula correcta del ion clorato es ClO3 -.