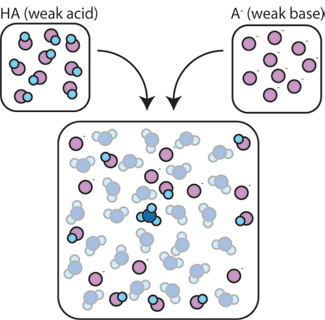
cum ajută un amestec de acid slab și baza sa conjugată să tamponeze o soluție împotriva modificărilor pH-ului?
dacă amestecăm un acid slab (HA) cu baza conjugată (A -), atât componentele acide, cât și cele de bază rămân prezente în soluție. Acest lucru se datorează faptului că nu suferă reacții care să le modifice semnificativ concentrațiile. Acidul și baza conjugată pot reacționa unul cu celălalt, HA + A- → A- + HA, dar atunci când fac acest lucru, pur și simplu schimbă locurile și concentrațiile și nu se schimbă. În plus, HA și A – rareori reacționează cu apa., Prin definiție, un acid slab este unul care rareori disociază în apă (adică, rareori acidul își va pierde protonul H+ în apă). De asemenea, deoarece baza conjugată A – este o bază slabă, rareori fură un proton H+ din apă.deci, acidul slab și baza slabă rămân în soluție cu concentrații mari, deoarece reacționează foarte rar cu apa. Cu toate acestea, este foarte probabil să reacționeze cu orice bază puternică adăugată sau acid puternic.,
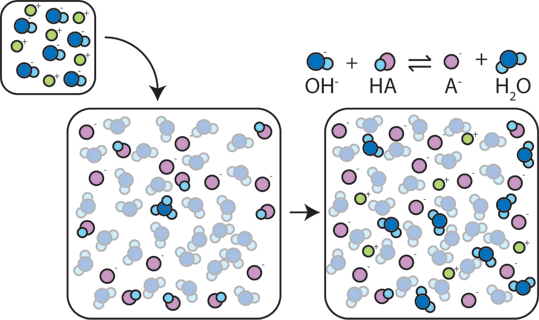
Dacă o bază puternică este adăugat la un tampon, slab acid va renunța la H+, în scopul de a transforma baza (OH-) în apă (H2O) și baza conjugată: HA + OH- → A- + H2O. De când a adăugat OH – este consumat de această reacție, pH-ul se va schimba doar ușor.
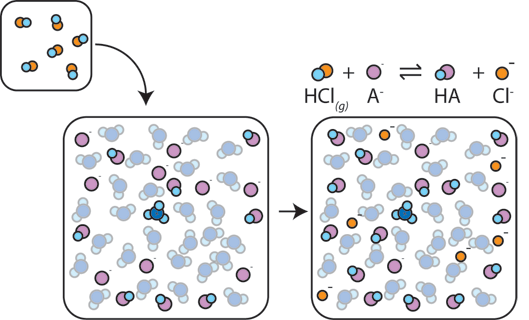
dacă un acid puternic este adăugat la un tampon, baza slabă va reacționa cu H+ din acidul puternic pentru a forma acidul slab HA: H + + A – → HA. H+ este absorbit de A – în loc să reacționeze cu apa pentru a forma H3O+ (H+), astfel încât pH-ul se schimbă doar ușor.,
vedeți pagina următoare pentru un tutore care vă conduce prin calculele implicate în crearea unui tampon.