Wie hilft eine Mischung aus einer schwachen Säure und ihrer konjugierten Base, eine Lösung gegen pH-Veränderungen zu puffern?
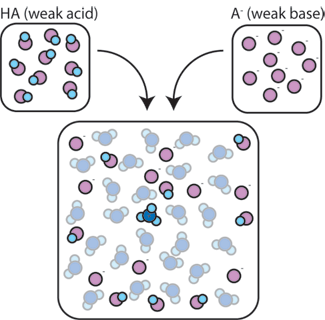
Wenn wir eine schwache Säure (HA) mit ihrer konjugierten Base (A -) mischen, bleiben sowohl die Säure-als auch die Basenkomponenten in der Lösung vorhanden. Dies liegt daran, dass sie keine Reaktionen erfahren, die ihre Konzentrationen signifikant verändern. Die Säure und die konjugierte Base können miteinander reagieren, HA + A – → A – + HA, aber wenn sie dies tun, tauschen sie einfach Orte und die Konzentrationen aus und ändern sich nicht. Außerdem reagieren HA und A – nur selten mit Wasser., Per Definition ist eine schwache Säure eine, die nur selten in Wasser dissoziiert (dh nur selten verliert die Säure ihr Proton H+ an Wasser). Ebenso, da die konjugierte Basis A – eine schwache Basis ist, stiehlt sie selten ein Proton H+ aus Wasser.
So verbleiben die schwache Säure und die schwache Base in der Lösung mit hohen Konzentrationen, da sie nur selten mit dem Wasser reagieren. Sie reagieren jedoch sehr wahrscheinlich mit einer zugesetzten starken Base oder starken Säure.,
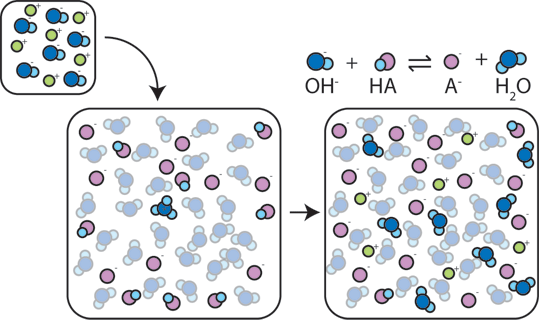
Wenn eine starke Base zu einem Puffer hinzugefügt wird, gibt die schwache Säure ihr H+ auf, um die Base (OH-) in Wasser (H2O) und die konjugierte Base umzuwandeln: HA + OH- → A- + H2O. Da das hinzugefügte OH – durch diese Reaktion verbraucht wird, ändert sich der pH-Wert nur geringfügig.
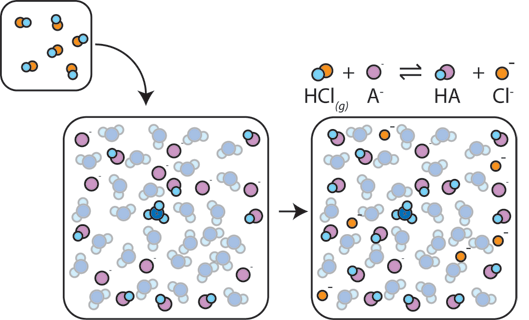
Wenn einem Puffer eine starke Säure zugesetzt wird, reagiert die schwache Base mit dem H+ aus der starken Säure zur Bildung der schwachen Säure HA: H+ + A- → HA. Das H+ wird vom A-absorbiert, anstatt mit Wasser zu H3O+ (H+) zu reagieren, so dass sich der pH-Wert nur geringfügig ändert.,
Auf der nächsten Seite finden Sie einen Tutor, der Sie durch die Berechnungen führt, die mit der Erstellung eines Puffers verbunden sind.