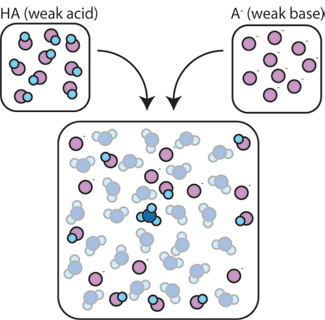
Jak mieszanina słabego kwasu i jego sprzężonej Zasady pomaga buforować roztwór przed zmianami pH?
Jeśli zmieszamy słaby kwas (HA) z jego sprzężoną zasadą (A -), zarówno składniki kwasowe, jak i zasadowe pozostają obecne w roztworze. Dzieje się tak dlatego, że nie ulegają one żadnym reakcjom, które znacząco zmieniają ich stężenie. Kwas i sprzężona zasada mogą reagować ze sobą, HA + A – → A – + HA, ale gdy to robią, po prostu wymieniają miejsca i stężenia i nie zmieniają się. Ponadto HA i A – rzadko reagują z wodą., Z definicji słaby kwas to taki, który tylko rzadko dysocjuje w wodzie (czyli tylko rzadko traci swój proton H+ na rzecz wody). Podobnie, ponieważ sprzężona baza A-jest słabą bazą, rzadko kradnie z wody proton H+.
tak więc słaby kwas i słaba zasada pozostają w roztworze o wysokich stężeniach, ponieważ rzadko reagują z wodą. Jednak są one bardzo prawdopodobne, aby reagować z każdym dodatkiem silnej Zasady lub mocnego kwasu.,
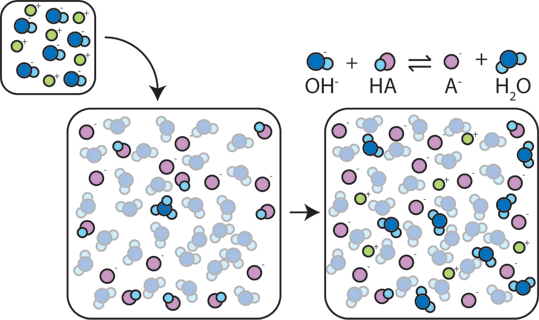
Jeśli mocna zasada zostanie dodana do bufora, słaby kwas zrezygnuje z H+ w celu przekształcenia Zasady (OH-) w wodę (H2O) i sprzężonej Zasady: HA + OH- → A- + H2O. ponieważ dodana zasada OH – jest zużywana w wyniku tej reakcji, pH zmieni się tylko nieznacznie.
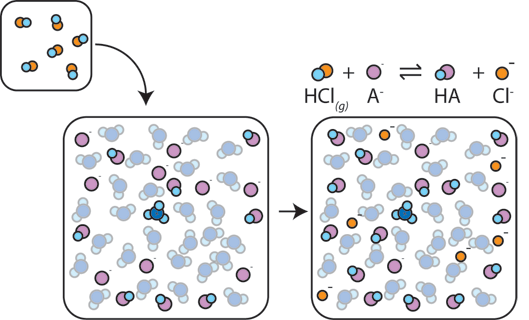
Jeśli silny kwas zostanie dodany do bufora, słaba zasada zareaguje z H+ z mocnego kwasu, tworząc słaby kwas HA: H+ + a- → HA. H+ zostaje wchłonięte przez A – zamiast reagować z wodą, tworząc H3O+ (H+), więc pH zmienia się tylko nieznacznie.,
na następnej stronie znajdziesz korepetytora, który przeprowadzi Cię przez obliczenia związane z tworzeniem bufora.