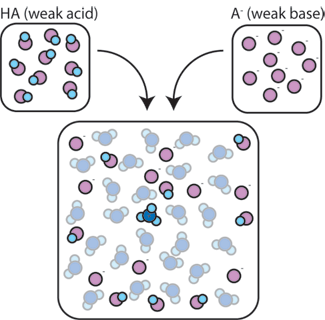
como é que uma mistura de um ácido fraco e da sua base conjugada ajuda a amortecer uma solução contra alterações de pH? se misturarmos um ácido fraco (HA) com a sua base conjugada (a -), ambos os componentes ácido e base permanecem presentes na solução. Isto porque eles não sofrem quaisquer reações que alteram significativamente suas concentrações. A base ácido e conjugado podem reagir uns com os outros, HA + A- → A- + HA, mas quando o fazem, simplesmente trocam de lugar e de concentração e não mudam. Além disso, HA e A – só raramente reagem com água., Por definição, um ácido fraco é aquele que raramente se dissocia na água (ou seja, raramente o ácido perde seu próton h+ para a água). Da mesma forma, uma vez que a base conjugada A – é uma base fraca, raramente rouba um próton h+ da água.assim, o ácido fraco e a base fraca permanecem na solução com concentrações elevadas, uma vez que raramente reagem com a água. No entanto, é muito provável que reajam com qualquer base forte adicionada ou ácido forte.,
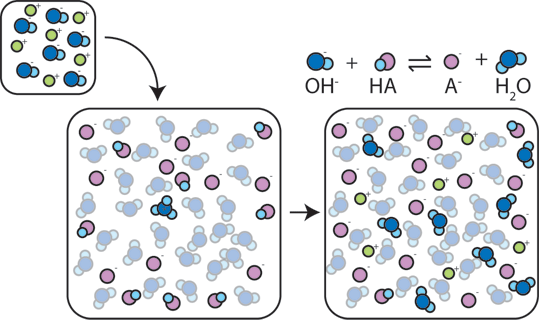
Se uma base forte é adicionado a um buffer, o ácido fraco vai desistir de sua H+ para transformar a base (OH-) em água (H2O) e o conjugado da base de dados: HA + OH- → A- + H2O. Desde adicionado OH – é consumido por esta reação, o pH vai mudar só um pouco.
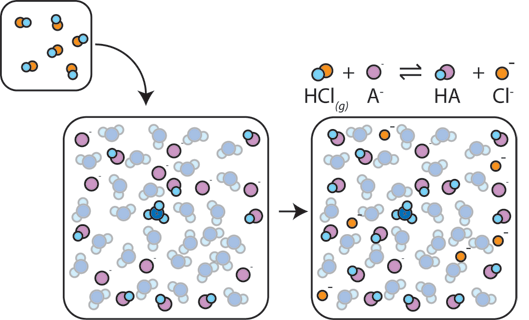
If a strong acid is added to a buffer, the weak base will react with the h+ from the strong acid to form the weak acid HA: H+ + A – → HA. O H+ é absorvido pelo a – em vez de reagir com a água para formar H3O+ (H+), de modo que o pH muda apenas ligeiramente.,
ver a página seguinte para um tutor que o conduz através dos cálculos envolvidos em fazer um buffer.