Hoe helpt een mengsel van een zwak zuur en zijn geconjugeerde base een oplossing te bufferen tegen pH-veranderingen?
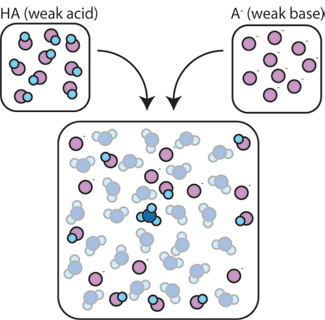
als we een zwak zuur (HA) mengen met zijn geconjugeerde base (A-), blijven zowel de zuur-als de base-componenten aanwezig in de oplossing. Dit komt omdat zij Geen reacties ondergaan die hun concentraties significant veranderen. Het zuur en de geconjugeerde base kunnen met elkaar reageren, HA + A- → A- + HA, maar als ze dat doen, wisselen ze gewoon van plaats en concentratie en veranderen ze niet. Bovendien reageren HA en A slechts zelden met water., Een zwak zuur is per definitie een zuur dat slechts zelden loskomt in water (dat wil zeggen, slechts zelden zal het zuur zijn proton H+ verliezen aan water). Aangezien de geconjugeerde base A-een zwakke base is, steelt het zelden een proton H+ uit water.
het zwakke zuur en de zwakke base blijven dus in hoge concentraties in de oplossing, omdat ze slechts zelden met het water reageren. Echter, ze zijn zeer waarschijnlijk om te reageren met een toegevoegde sterke base of sterk zuur.,
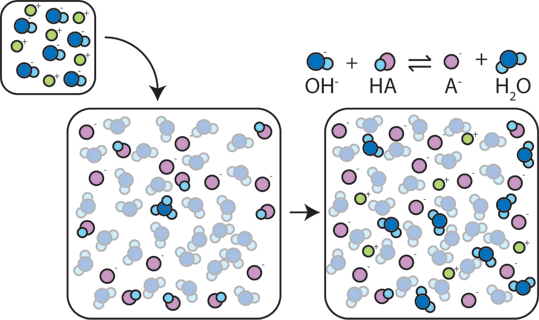
als een sterke base aan een buffer wordt toegevoegd, zal het zwakke zuur zijn H+ opgeven om de base (OH-) om te zetten in water (H2O) en de geconjugeerde base: HA + OH- → A- + H2O. aangezien de toegevoegde OH – wordt verbruikt door deze reactie, zal de pH slechts licht veranderen.
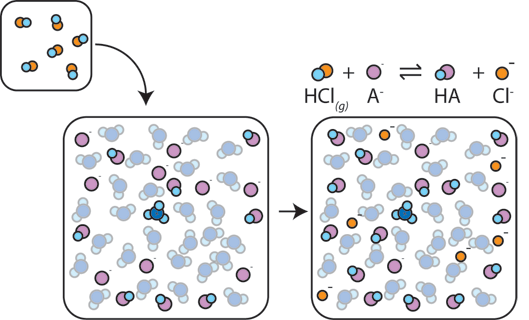
als een sterk zuur aan een buffer wordt toegevoegd, zal de zwakke base reageren met de H+ uit het sterke zuur om het zwakke zuur te vormen HA: H+ + A- → HA. De H+ wordt geabsorbeerd door de A – in plaats van te reageren met water om H3O+ (H+) te vormen, zodat de pH slechts licht verandert.,
zie de volgende pagina voor een tutor die u door de berekeningen leidt die betrokken zijn bij het maken van een buffer.