a estrutura de Lewis do íon ClO3 é desenhada passo a passo neste tutorial. Elétrons de Valência Total de átomos de oxigênio e cloro e carga negativa são considerados para desenhar a estrutura de ClO3 – lewis. Quando desenhamos a estrutura de lewis, a carga geral do íon deve ser -1.
Lewis Structure of nitrite ion
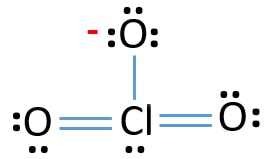
Now, we are going to learn, how to draw this lewis structure of ClO3 – ion step by step.,
Steps of drawing ClO3 – lewis structure
Following steps are required to draw ClO3-lewis structure and they are explained in detail in this tutorial.
- Encontrar o número total de elétrons de valência conchas de cloro e átomos de oxigênio e incluindo a carga do ânion
- Total de pares de elétrons de valência conchas
- Determinar o centro do átomo de cloro e o átomo de oxigênio
- Coloque solitário pares de átomos
- a Estabilidade da estrutura de lewis – Verificar a estabilidade e minimizar as cargas sobre os átomos convertendo solitário pares de obrigações para obter a melhor estrutura.,desenhar a estrutura correcta de lewis é importante para desenhar estruturas de ressonância de ClO3 -.
número Total de electrões das camadas de Valência dos átomos de cloro e oxigénio e carga do ânion
Existem um átomo de cloro e três átomos de oxigénio no ião clorato. Também há uma carga-1 no íon ClO3.
cloro e oxigénio estão localizados em 7 e 6 grupos, respectivamente, na tabela periódica. Então o cloro tem sete elétrons em sua concha de Valência. No átomo de oxigénio, há seis electrões na sua concha de Valência.,hlorine átomos = 7*1 = 7
- Total de elétrons de valência dada por átomos de oxigênio = 6 *3 = 18
- Devido a -1 carga, recebeu elétrons de valência os elétrons= 1
- Total de elétrons de valência = 7 + 18 + 1 = 26
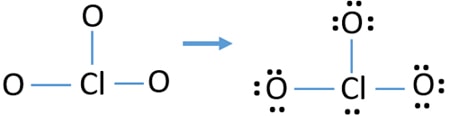
- There are already three Cl-o bonds in the sketch., Portanto, apenas dez pares de elétrons de Valência estão restando para desenhar o resto do íon.
- próximo passo é, marcando esses elétrons de dez Valência pares em átomos externos (átomos de oxigênio) como pares isolados. Um átomo de oxigênio tomará três pares solitários seguindo a regra octal (átomos de oxigênio não podem manter mais de oito elétrons em suas conchas de Valência). Portanto, nove pares de elétrons são marcados em três átomos de oxigênio. Agora, resta um par de elétrons (10-9).
- Então, o par de elétrons restante é marcado no átomo de cloro.,
Existem três átomos de oxigênio em ClO3- , Portanto
Devido a -1 carga, outro elétrons é adicionado
Total de elétrons de valência pares
Total de valência elétrons pares = σ obrigações + π obrigações + solitário pares, em valência conchas
Total de pares de elétrons são determinados dividindo-se o número total de elétrons de valência por dois., Para, ClO3-existem 26 elétrons de Valência, então pares totais de elétrons são 13.
átomo central de ClO3 – ion
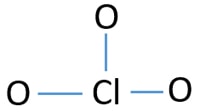
para ser o átomo central, a capacidade de ter maior valância é importante. O cloro pode mostrar Valência 7. Mas a valência máxima do oxigénio é de 2. Portanto, o cloro tem mais chance de ser o átomo central (veja a figura). Então, agora podemos construir um esboço de ClO3 – ion.
Sketch of ClO3-ion
Lone pairs on atoms
Verificar a estabilidade da estrutura desenhada de ClO3 – ion e reduzir os encargos sobre átomos convertendo solitário pares de obrigações
Verifique encargos sobre átomos e marcá-los como abaixo. As cargas são importantes para decidir a melhor estrutura de lewis do íon.

A estrutura desenhada para ClO3 – não é uma estrutura estável porque átomos de oxigênio e átomos de cloro têm cargas. Além disso, quando a carga de um átomo é grande, essa estrutura torna-se mais instável. Quando uma molécula ou íon tem tantas cargas em átomos, essa estrutura não é estável.,
Now, we should try to minimize charges by converting lone pair or pairs which exist on oxygen atoms to bonds. Então nós convertemos um único par de um átomo de oxigênio como uma ligação Cl-O como na figura seguinte.
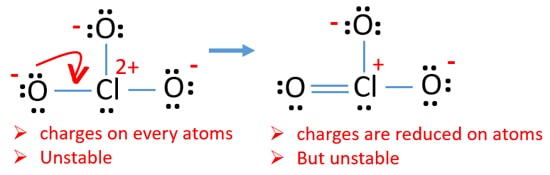
Now there is a double bond between chlorine and one oxygen atom. Existem também duas ligações únicas (Cl-O) com o átomo de cloro e outros dois átomos de oxigénio.
mas, ainda existem cargas sobre átomos. Se possível, deveríamos também reduzir as taxas. Outro Par solitário em outro átomo de oxigênio é transferido como uma ligação Cl-O.,
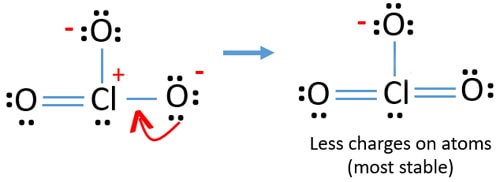
Now, there are twelve electrons around chlorine atom. Isto é aceitável porque o cloro pode manter mais de oito elétrons que o cloro não preencheu órbitas 3d.na nova estrutura, as cargas dos átomos são reduzidas. Agora não há nenhuma carga em dois átomos de oxigênio. Além disso, a carga do átomo de cloro é reduzida a zero. Agora você entende que esta estrutura de ClO3-é mais estável do que a estrutura anterior devido a menos cargas nos átomos.,
ClO3 – estrutura de Lewis

Dúvidas
Peça sua química perguntas e encontrar as respostas
o Que é a forma em volta do átomo de cloro no ClO3 – ion?
Existem três ligações σ e um único par em torno do átomo de cloro na estrutura de lewis do íon ClO3. Portanto, a forma de íon é trigonal piramidal.quantas cargas nos átomos da estrutura de lewis iónica clorada?
apenas um átomo de oxigénio tem uma carga -1. Todos os outros átomos não têm cargas. Portanto, a carga geral do ião clorato é -1.,
clo3 estrutura de lewis
não há molécula ou íon como ClO3. A fórmula correta do íon clorato é ClO3 -.tutoriais relacionados