Lewis szerkezete ClO3 – ion készül lépésről lépésre ebben a bemutatóban. Teljes valence elektronok oxigén, klór atomok negatív töltés tartják felhívni a ClO3 – lewis szerkezet. Amikor a lewis szerkezetet rajzoltuk, az ion teljes töltésének -1-nek kell lennie.
Lewis szerkezete nitrit ion
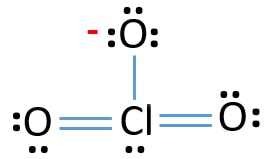
most, meg fogjuk tanulni, hogyan kell felhívni ezt lewis szerkezete ClO3 – ion lépésről lépésre.,
A clo3 – lewis szerkezet rajzolásának lépései
a ClO3 – lewis szerkezet rajzolásához A következő lépések szükségesek, amelyeket részletesen ismertetünk ebben a bemutatóban.
- Találni száma elektronok a valance kagyló, a klór, illetve oxigén atomok, beleértve felelős az anion
- Teljes elektronok pár valence kagyló
- Meghatározni középső atom, a klór, illetve oxigén atom
- Tedd magányos pár atomok
- Stabilitását lewis szerkezet – Ellenőrizze, hogy a stabilitási, illetve minimalizálja díjak atomok átalakításával magányos pár kötvények megszerzése a legjobb szerkezet.,
rajz helyes lewis szerkezet fontos felhívni rezonancia struktúrák ClO3 -.
száma elektronok a valance kagyló, a klór, illetve oxigén atomok, illetve felelős az anion
Van egy klór atom három oxigén atomok, a klorid-ion. Szintén van egy -1 töltés a ClO3-ionon.
a klór és az oxigén a periódusos rendszerben 7, illetve 6 csoportban található. Tehát a klórnak hét elektronja van a valenciahéjában. Az oxigénatomban hat elektron van a valenciahéjában.,hlorine atomok = 7*1 = 7
három oxigén atomok, ClO3- , Ezért
- Teljes valence elektronok által megadott oxigén atomok = 6 *3 = 18
Miatt -1 felelős, a másik az elektronok egészül ki
- Miatt -1 díj, kapott az elektronok, hogy valence elektronok= 1
- Teljes valence elektronok = 7 + 18 + 1 = 26
Teljes valence elektronok párokba
a Teljes valance elektronok párokba = σ kötvények + π kötések + magányos pár valence kagyló
a Teljes elektron párok elosztják a szám teljes valence elektronok által két., Mert, ClO3 – vannak 26 valence elektronok, így a teljes pár elektronok 13.
Clo3 – ion középső atomja
ahhoz, hogy a középső atom legyen, fontos a nagyobb valance képessége. Klór mutatja valence 7. De az oxigén maximális értéke 2. Ezért a klórnak nagyobb esélye van arra, hogy a középső atom legyen (lásd az ábrát). Tehát most építhetünk egy vázlatot a ClO3-ionról.
A ClO3 – ion vázlata
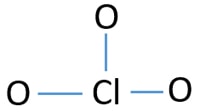
magányos Párok az atomokon
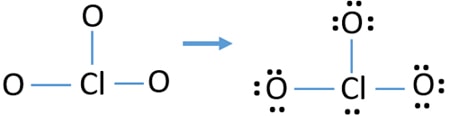
- már három Cl-O kötés van a vázlatban., Ezért csak tíz valence elektron pár marad, hogy felhívja a többi ion.
- a következő lépés az, hogy ezeket a tíz vegyértékű elektronpárokat a külső atomokon (oxigénatomok) magányos párként jelöljük. Egy oxigénatom három magányos párot vesz igénybe az oktális szabályt követve (az oxigénatomok nem tarthatnak több mint nyolc elektronot a valenciahéjukban). Ezért kilenc elektron pár van jelölve három oxigénatomon. Most egy elektron pár (10-9) marad.
- ezután a maradék elektronpár klóratomon van jelölve.,
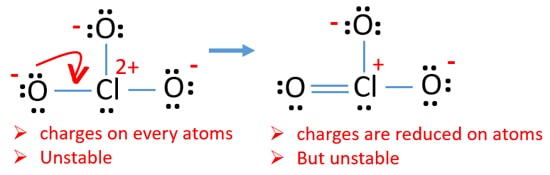
Ellenőrizze a stabilitás készült szerkezet, ClO3 – ion, valamint csökkenti a díjak atomok átalakításával magányos pár kötvények
Ellenőrizze a díjak atomok jegyezd meg, mint az alábbi. A töltések fontosak az ion legjobb lewis szerkezetének meghatározásához.

a clo3 rajzolt szerkezete nem stabil, mert az oxigénatomok és a klóratomok töltéssel rendelkeznek. Továbbá, ha egy atom töltése nagy, ez a szerkezet instabillá válik. Amikor egy molekulának vagy ionnak annyi töltése van az atomokra, ez a szerkezet nem stabil.,
most meg kell próbálnunk minimalizálni a töltéseket úgy, hogy az oxigénatomokon létező magányos párokat vagy párokat kötésekké alakítjuk. Tehát egy oxigénatom egy magányos párját Cl-O kötésként alakítjuk át, mint a következő ábrán.
most kettős kötés van a klór és egy oxigénatom között. A klór-atom mellett két egykötésű (Cl-O) és két másik oxigénatom is van.
de még mindig vannak töltések az atomokon. Ha lehetséges, csökkenteni kell a díjakat is. Egy másik oxigénatom másik magányos párja Cl-O kötésként kerül átadásra.,
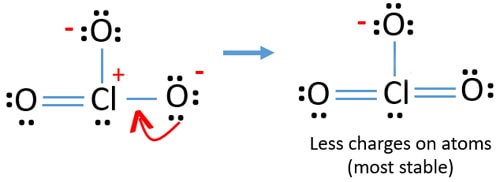
most tizenkét elektron van a klóratom körül. Ez azért elfogadható, mert a klór több mint nyolc elektront képes megtartani, a klór nem töltött 3D pályákat.
új szerkezetben az atomok töltése is csökken. Most nincs töltés két oxigénatomon. Továbbá a klóratom töltése nullára csökken. Most már értem, ez a szerkezet a ClO3-stabilabb, mint a korábbi szerkezet miatt kevesebb töltések atomok.,
ClO3-Lewis structure

kérdések
kérdezze meg kémiai kérdéseit, és keresse meg a válaszokat
mi a klór atom körüli alak a Klo3-ionban?
a Klo3 – ion lewis szerkezetében három σ kötés és egy egy magányos pár van a klór atom körül. Ezért az ion alakja trigonális piramis.
hány töltést tartalmaz a klorát ion lewis szerkezetű atomokban?
csak egy oxigénatom rendelkezik a -1 töltéssel. Minden más atomnak nincs töltése. Ezért a klorátion teljes töltése -1.,
clo3 lewis szerkezet
nincs molekula vagy ion, mint ClO3. A klorátion megfelelő képlete a ClO3-.