La structure de Lewis de ClO3-ion est dessinée étape par étape dans ce tutoriel. On considère que les électrons de valence totale des atomes d’oxygène et de chlore et la charge négative dessinent la structure de ClO3 – lewis. Lorsque nous avons dessiné la structure de Lewis, la charge globale de l’ion devrait être de -1.
Structure de Lewis de l’ion nitrite
Maintenant, nous allons apprendre, comment dessiner cette structure de lewis de l’ClO3 – ion, étape par étape.,
Étapes de dessin de la structure ClO3 – lewis
Les étapes suivantes sont nécessaires pour dessiner la structure ClO3 – lewis et elles sont expliquées en détail dans ce tutoriel.
- Trouver le nombre total d’électrons des coques de valence des atomes de chlore et d’oxygène et y compris la charge de l’anion
- Paires d’électrons totaux dans les coques de valence
- Déterminer l’atome central à partir de l’atome de chlore et d’oxygène
- Mettre des paires solitaires sur les atomes
- Stabilité de la structure de lewis – Vérifier la stabilité et minimiser les charges sur les atomes en convertissant les paires solitaires en liaisons pour obtenir la meilleure structure.,
Dessiner une structure de Lewis correcte est important pour dessiner des structures de résonance de ClO3-.
Nombre total d’électrons des enveloppes de cantonnière des atomes de chlore et d’oxygène et charge de l’anion
Il y a un atome de chlore et trois atomes d’oxygène dans l’ion chlorate. Il y a aussi une charge -1 sur le ClO3 – ion.
Le chlore et l’oxygène sont situés respectivement à 7 et 6 groupes dans le tableau périodique. Donc, le chlore a sept électrons dans sa coquille de valence. Dans l’atome d’oxygène, il y a six électrons dans sa coquille de valence.,atomes de chlore = 7*1 = 7
Il y a trois atomes d’oxygène dans ClO3- , Donc
- Électrons de valence totaux donnés par les atomes d’oxygène = 6 *3 = 18
En raison de la charge -1, un autre électrons est ajouté
- En raison de la charge -1, électrons de valence = 7 + 18 + 1 = 26
Paires d’électrons de valence totale
Paires d’électrons de valence totale = liaisons σ + liaisons π + paires solitaires aux coquilles de valence
Les paires d’électrons totales sont déterminées en divisant le nombre d’électrons de valence totale par deux., Pour, ClO3 – il y a 26 électrons de valence, donc les paires totales d’électrons sont 13.
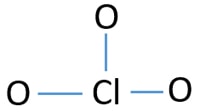
Atome central de l’ion ClO3
Pour être l’atome central, la capacité d’avoir une plus grande cantonnière est importante. Le chlore peut montrer valence 7. Mais, la valence maximale de l’oxygène est de 2. Par conséquent, le chlore a plus de chances d’être l’atome central (voir la figure). Donc, maintenant nous pouvons construire un croquis de ClO3-ion.
Croquis de ClO3 – ion
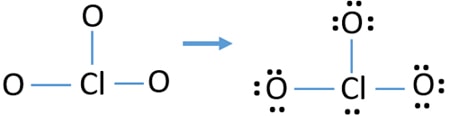
Paires solitaires sur les atomes
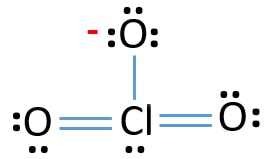
- Il y a déjà trois liaisons Cl-O dans l’esquisse., Par conséquent, il ne reste que dix paires d’électrons de valence pour attirer le reste de l’ion.
- L’étape suivante consiste à marquer ces dix paires d’électrons de valence sur des atomes extérieurs (atomes d’oxygène) comme des paires solitaires. Un atome d’oxygène prendra trois paires solitaires suivant la règle octale (les atomes d’oxygène ne peuvent pas garder plus de huit électrons dans leurs coquilles de valence). Par conséquent, neuf paires d’électrons sont marquées sur trois atomes d’oxygène. Maintenant, il reste une paire d’électrons (10-9).
- Ensuite, la paire d’électrons restante est marquée sur l’atome de chlore.,
Vérifiez la stabilité de la structure dessinée de l’ion ClO3 et réduisez les charges sur les atomes en convertissant les paires solitaires en liaisons
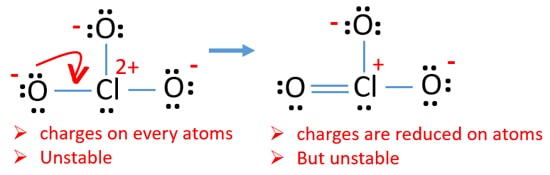
Vérifiez les charges sur les atomes et marquez – les comme ci-dessous. Les charges sont importantes pour décider de la meilleure structure de Lewis de l’ion.

La structure dessinée pour ClO3 – n’est pas une structure stable car les atomes d’oxygène et les atomes de chlore ont des charges. En outre, lorsque la charge d’un atome est grande, cette structure devient plus instable. Quand une molécule ou un ion a autant de charges sur les atomes, cette structure n’est pas stable.,
Maintenant, nous devrions essayer de minimiser les charges en convertissant la ou les paires isolées qui existent sur les atomes d’oxygène en liaisons. Nous convertissons donc une seule paire d’un atome d’oxygène en liaison Cl-O comme dans la figure suivante.
Il existe maintenant une double liaison entre le chlore et un atome d’oxygène. Il existe également deux liaisons simples (Cl-O) avec un atome de chlore et deux autres atomes d’oxygène.
Mais, il y a encore des charges sur les atomes. Si possible, nous devrions réduire les frais en outre. Une autre paire isolée sur un autre atome d’oxygène est transférée sous forme de liaison Cl-O.,
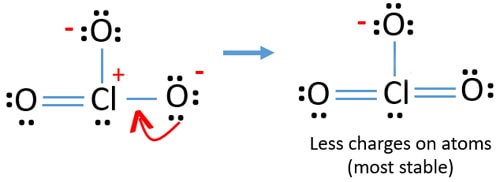
Maintenant, il y a douze électrons autour de l’atome de chlore. Ceci est acceptable car le chlore peut garder plus de huit électrons le chlore a des orbites 3d non remplies.
Dans une nouvelle structure, les charges des atomes sont également réduites. Maintenant, il n’y a pas de charge sur deux atomes d’oxygène. En outre, la charge de l’atome de chlore est réduite à zéro. Maintenant, vous comprenez cette structure de ClO3-est plus stable que la structure précédente en raison de moins de charges sur les atomes.,
Structure de ClO3 – Lewis

Questions
Posez vos questions de chimie et trouvez les réponses
Quelle est la forme autour de l’atome de chlore dans l’ion ClO3?
Il y a trois liaisons σ et une seule paire autour de l’atome de chlore dans la structure de Lewis de l’ion ClO3. Par conséquent, la forme de l’ion est pyramidale trigonale.
Combien de charges dans les atomes de la structure de lewis de l’ion chlorate?
Un seul atome d’oxygène a une charge de -1. Tous les autres atomes n’ont pas de charges. Par conséquent, la charge globale de l’ion chlorate est de -1.,
clo3 structure de lewis
Il n’y a pas de molécule ou d’ion comme ClO3. La formule correcte de l’ion chlorate est ClO3 -.