Le .is structure of ClO3 – ion tegnes trin for trin i denne tutorial. Alt valence elektroner af ilt og klor atomer og negativ ladning anses for at trække ClO3 – lewis struktur. Når vi trak le .is-strukturen, skal den samlede ladning af ionen være -1.
Lewis Struktur af nitrit-ion –
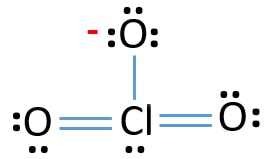
Nu, vi kommer til at lære, hvordan man tegner denne lewis struktur af ClO3 – ion-trin for trin.,
trin til tegning af ClO3 – le .is – struktur
følgende trin er nødvendige for at tegne ClO3-le .is-struktur, og de forklares detaljeret i denne tutorial.
- Find samlede antal elektroner i valance skaller af klor-og ilt-atomer, og herunder ansvaret for anion
- Samlet elektroner par i valence skaller
- Afgøre, center atom fra klor og ilt atom
- Sat enlige par på atomer
- Stabiliteten af lewis struktur – Check stabilitet og minimere afgifter på atomer ved at konvertere enlige par obligationer for at få den bedste struktur.,
tegning korrekt le .is struktur er vigtigt at tegne resonans strukturer af ClO3-.
Samlet antal elektroner af valance skaller af chlor og O oxygenygenatomer og ladning af anion
Der er et kloratom og tre o .ygenatomer i chlorationen. Der er også en -1 ladning på ClO3 – ion.
chlor og O oxygenygen er placeret i henholdsvis 7 og 6 grupper i det periodiske system. Så klor har syv elektroner i sin valensskal. I O oxygenygenatom er der seks elektroner i dens valensskal.,hlorine atomer = 7*1 = 7
Der er tre ilt-atomer i ClO3 – Derfor
- Samlet valence elektroner givet af ilt atomer = 6 *3 = 18
på Grund -1 beregning, en anden elektroner er tilføjet
- Følge -1 afgift, modtaget elektroner til valence elektroner= 1
- Samlet valence elektroner = 7 + 18 + 1 = 26
Alt valence elektroner par
Alt valance elektroner par = σ obligationer + π obligationer + enlige par i valence skaller
Alt elektron-par, er bestemt ved at dividere det samlede antal valence elektroner med to., For, ClO3-der er 26 valenselektroner, så samlede par elektroner er 13.
Center atom af ClO3 – ion
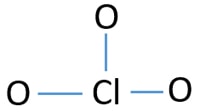
for at være det centrale atom er evnen til at have større valance vigtig. Klor kan vise Valens 7. Men o oxygenygens maksimale valens er 2. Derfor klor har større chance for at være det centrale atom (se figuren). Så nu kan vi bygge en skitse af ClO3-ion.
Skitse af ClO3 – ion
Enlige par på atomer
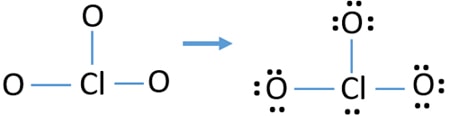
- Der er allerede tre Cl-O obligationer i skitsen., Derfor er der kun ti valenselektronpar tilbage for at trække resten af ion.
- næste trin er at markere disse ti valenselektronpar på udvendige atomer (o .ygenatomer) som ensomme par. Et ilt-atom vil tage tre enlige par efter oktal-reglen (ilt-atomer ikke kan holde mere end otte elektroner i deres valence skaller). Derfor er ni elektronpar markeret på tre o .ygenatomer. Nu er et elektronpar (10-9) tilbage.
- derefter er det resterende elektronpar markeret på kloratom.,
Find stabilitet trukket struktur af ClO3 – ion og mindske afgifterne på atomer ved at konvertere enlige par obligationer
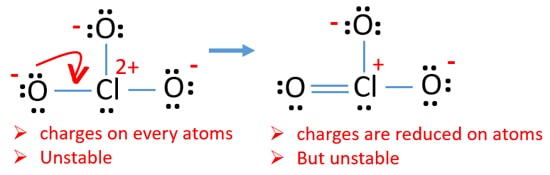
Check afgifter på atomer og markere dem som nedenfor. Afgifter er vigtige for at bestemme den bedste le .is-struktur af ion.

den tegnede struktur for ClO3 – er ikke en stabil struktur, fordi o .ygenatomer og kloratomer har ladninger. Når ladningen af et atom er stor, bliver denne struktur også mere ustabil. Når et molekyle eller ion har så mange ladninger på atomer, er denne struktur ikke stabil.,
nu skal vi forsøge at minimere afgifter ved at konvertere ensomme par eller par, der findes på iltatomer til bindinger. Så vi konverterer et enkelt par af et iltatom som en Cl – o-binding som i den følgende figur.
Nu er der en dobbeltbinding mellem klor og et ilt-atom. Der er også to enkeltbindinger (Cl-O) med kloratom og andre to O oxygenygenatomer.
men der er stadig afgifter på atomer. Hvis det er muligt, bør vi reducere afgifter yderligere. Et andet ensomt par på et andet iltatom overføres som en Cl-o-binding.,
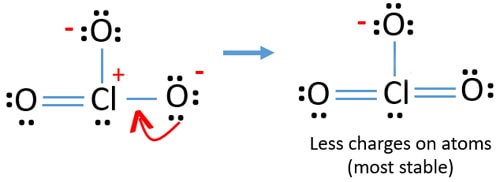
nu er der tolv elektroner omkring kloratom. Dette er acceptabelt, fordi klor kan holde mere end otte elektroner klor har ubesatte 3d-baner.
i ny struktur reduceres ladninger af atomer endvidere. Nu er der ingen ladning på to iltatomer. Også ladningen af kloratom reduceres til nul. Nu forstår du denne struktur af ClO3-er mere stabil end tidligere struktur på grund af mindre afgifter på atomer.,
ClO3 – Lewis struktur

Spørgsmål
Spørg din kemi spørgsmål og finde svar
Hvad er den form omkring klor-atom i ClO3 – ion?
Der er tre bonds bindinger og en en enlig par omkring klor atom i Le .is struktur af ClO3 – ion. Derfor form af ion er trigonal pyramideformet.
hvor mange ladninger i atomer af chloration le ?is struktur?
kun et O oxygenygenatom har en -1-ladning. Alle andre atomer har ikke afgifter. Derfor er den samlede ladning af chloration -1.,
clo3 le .is struktur
Der er ingen molekyle eller ion som ClO3. Den korrekte formel for chloration er ClO3 -.