Hur hjälper en blandning av en svag syra och dess konjugatbas att buffra en lösning mot pH-förändringar?
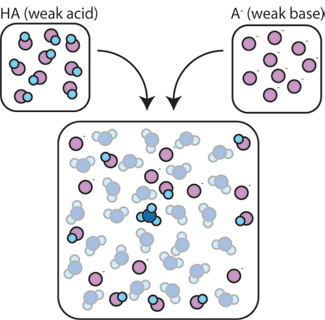
om vi blandar en svag syra (HA) med dess konjugatbas (a-), förblir både syra-och baskomponenterna närvarande i lösningen. Detta beror på att de inte genomgår några reaktioner som väsentligt förändrar deras koncentrationer. Syra – och konjugatbasen kan reagera med varandra, HA + a – → a – + HA, men när de gör det handlar de helt enkelt platser och koncentrationerna och förändras inte. Dessutom reagerar HA och A – endast sällan med vatten., Per definition är en svag syra en som endast sällan dissocierar i vatten (det vill säga bara sällan kommer syran att förlora sin proton h+ till vatten). På samma sätt, eftersom den konjugerade basen A – är en svag bas, stjäl den sällan en proton h+ från vatten.
så förblir den svaga syran och den svaga basen i lösningen med höga koncentrationer eftersom de endast sällan reagerar med vattnet. De är dock mycket benägna att reagera med någon tillsatt stark bas eller stark syra.,
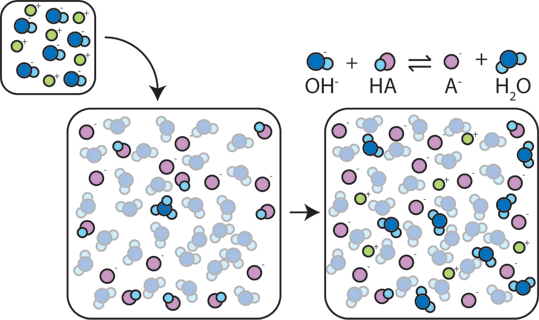
om en stark bas läggs till en buffert kommer den svaga syran att ge upp sin H + för att omvandla basen (OH -) till vatten (H2O) och den konjugerade basen: HA + OH – → a – + H2O. eftersom den tillsatta OH-förbrukas av denna reaktion kommer pH-värdet att ändras endast något.
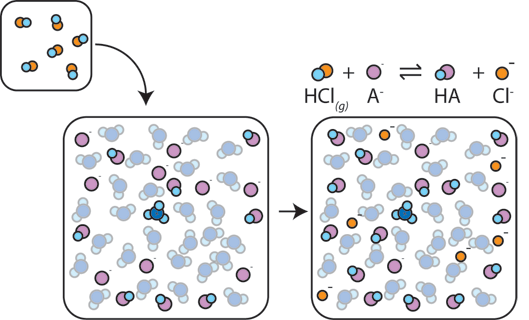
om en stark syra tillsätts till en buffert kommer den svaga basen att reagera med H+ från den starka syran för att bilda den svaga syran HA: H+ + A- → HA. H + absorberas av A-istället för att reagera med vatten för att bilda H3O+ (H+), så pH-värdet ändras bara något.,
Se Nästa sida för en handledare som leder dig genom beräkningarna som är involverade i att skapa en buffert.