In che modo una miscela di un acido debole e la sua base coniugata aiuta a tamponare una soluzione contro i cambiamenti di pH?
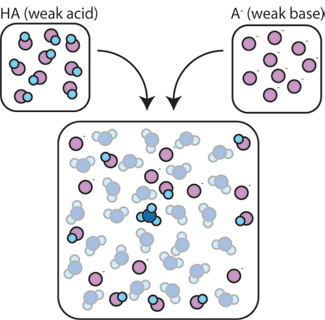
Se mescoliamo un acido debole (HA) con la sua base coniugata (A-), entrambi i componenti acido e base rimangono presenti nella soluzione. Questo perché non subiscono reazioni che alterano significativamente le loro concentrazioni. L’acido e la base coniugata possono reagire l’uno con l’altro, HA + A- → A- + HA, ma quando lo fanno, scambiano semplicemente i luoghi e le concentrazioni e non cambiano. Inoltre, HA e A-reagiscono solo raramente con l’acqua., Per definizione, un acido debole è uno che solo raramente si dissocia in acqua (cioè, solo raramente l’acido perderà il suo protone H+ in acqua). Allo stesso modo, poiché la base coniugata A – è una base debole, raramente ruba un protone H+ dall’acqua.
Quindi, l’acido debole e la base debole rimangono nella soluzione con alte concentrazioni poiché reagiscono solo raramente con l’acqua. Tuttavia, è molto probabile che reagiscano con qualsiasi base forte aggiunta o acido forte.,
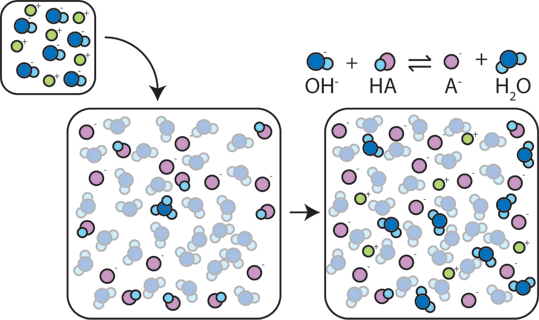
Se una base forte viene aggiunta a un buffer, l’acido debole rinuncerà al suo H+ per trasformare la base (OH-) in acqua (H2O) e la base coniugata: HA + OH- → A- + H2O. Poiché l’OH – aggiunto viene consumato da questa reazione, il pH cambierà solo leggermente.
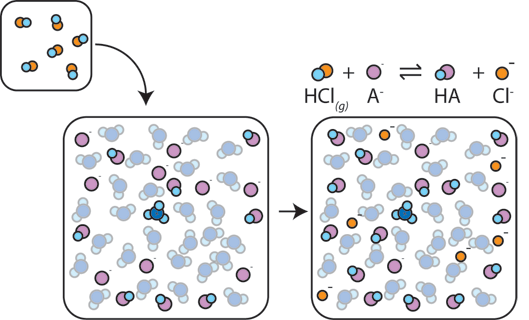
Se un acido forte viene aggiunto a un buffer, la base debole reagirà con l’H+ dall’acido forte per formare l’acido debole HA: H+ + A- → HA. L’H + viene assorbito dall’A – invece di reagire con l’acqua per formare H3O+ (H+), quindi il pH cambia solo leggermente.,
Vedi la pagina successiva per un tutor che ti guida attraverso i calcoli coinvolti nella creazione di un buffer.