Comment un mélange d’un acide faible et de sa base conjuguée aide-t-il à tamponner une solution contre les changements de pH?
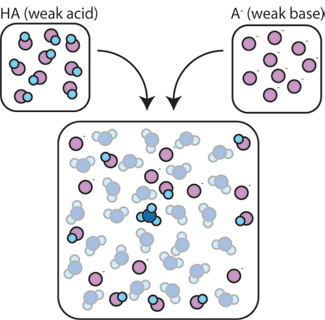
Si l’on mélange un acide faible (HA) avec sa base conjuguée (A-), les composants acide et base restent présents dans la solution. En effet, ils ne subissent aucune réaction qui modifie significativement leurs concentrations. L’acide et la base conjuguée peuvent réagir l’un avec l’autre, HA + A- → A- + HA, mais quand ils le font, ils échangent simplement les lieux et les concentrations et ne changent pas. De plus, HA et A – ne réagissent que rarement avec l’eau., Par définition, un acide faible est un acide qui ne se dissocie que rarement dans l’eau (c’est-à-dire que l’acide perd rarement son proton H+ dans l’eau). De même, comme la base conjuguée A-est une base faible, elle vole rarement un proton H+ de l’eau.
Ainsi, l’acide faible et la base faible restent dans la solution avec des concentrations élevées car ils ne réagissent que rarement avec l’eau. Cependant, ils sont très susceptibles de réagir avec n’importe quelle base forte ajoutée ou acide fort.,
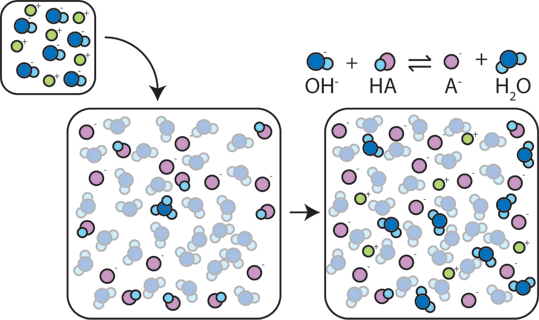
Si une base forte est ajoutée à un tampon, l’acide faible abandonnera son H+ pour transformer la base (OH-) en eau (H2O) et la base conjuguée: HA + OH- → A- + H2O. Puisque le OH – ajouté est consommé par cette réaction, le pH ne changera que légèrement.
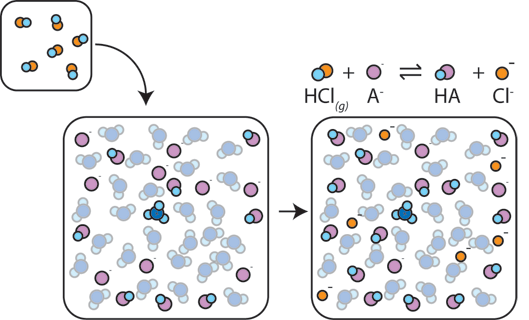
Si un acide fort est ajouté à un tampon, la faiblesse de la base réagit avec le H+ de l’acide fort pour former de l’acide faible HA: H+ + A- → HA. Le H + est absorbé par le A-au lieu de réagir avec l’eau pour former H3O+ (H+), de sorte que le pH ne change que légèrement.,
Voir la page suivante pour un tuteur qui vous guide à travers les calculs impliqués dans la réalisation d’un tampon.