¿cómo una mezcla de un ácido débil y su base conjugada ayuda a amortiguar una solución contra los cambios de pH?
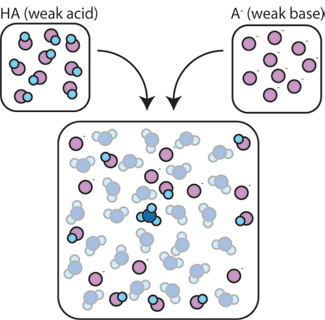
si mezclamos un ácido débil (HA) con su base conjugada (A -), los componentes ácido y base permanecen presentes en la solución. Esto se debe a que no sufren ninguna reacción que altere significativamente sus concentraciones. El ácido y la base conjugada pueden reaccionar entre sí, HA + A- → A- + HA, pero cuando lo hacen, simplemente intercambian lugares y concentraciones y no cambian. Además, HA y A-rara vez reaccionan con agua., Por definición, un ácido débil es uno que rara vez se disocia en el agua (es decir, solo rara vez el ácido perderá su protón H+ al agua). Del mismo modo, dado que la base conjugada A – es una base débil, rara vez roba un protón H+ del agua.
por lo tanto, el ácido débil y la base débil permanecen en la solución con altas concentraciones ya que solo rara vez reaccionan con el agua. Sin embargo, es muy probable que reaccionen con cualquier base fuerte o ácido fuerte agregado.,
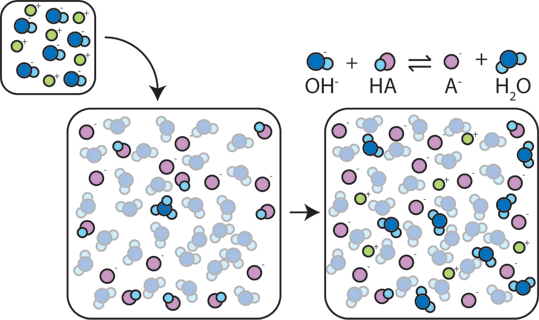
Si se agrega una base fuerte a un tampón, el ácido débil renunciará a su H+ para transformar la base (OH -) en agua (H2O) y la base conjugada: HA + OH- → A- + H2O. dado que el Oh – añadido es consumido por esta reacción, el pH cambiará solo ligeramente.
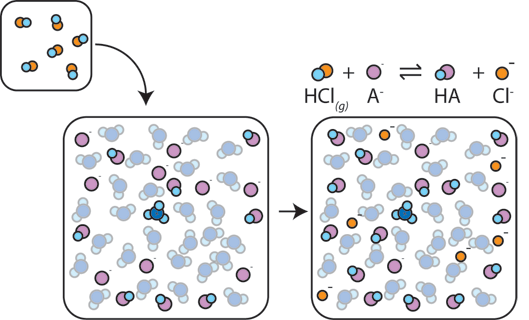
Si se agrega un ácido fuerte a un búfer, la base débil reaccionará con el H+ del ácido fuerte para formar el ácido débil HA: H+ + A- → ha. El H + es absorbido por el A – en lugar de reaccionar con agua para formar H3O+ (H+), por lo que el pH cambia solo ligeramente.,
vea la siguiente página para un tutor que lo guía a través de los cálculos involucrados en la creación de un búfer.