Hvordan hjælper en blanding af en svag syre og dens konjugatbase buffer en opløsning mod pH-ændringer?
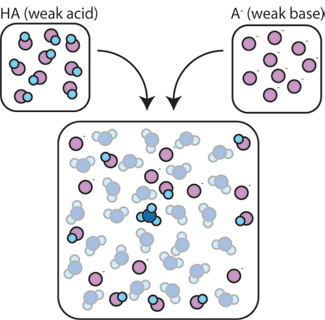
Hvis vi blander en svag syre (HA) med dens konjugatbase (a-), forbliver både syren og basekomponenterne til stede i opløsningen. Dette skyldes, at de ikke undergår nogen reaktioner, der væsentligt ændrer deres koncentrationer. Syre – og konjugatbasen kan reagere med hinanden, HA + A – A A – + HA, men når de gør det, handler de simpelthen steder og koncentrationerne og ændrer sig ikke. Derudover reagerer HA og A – kun sjældent med vand., Per definition er en svag syre en, der kun sjældent dissocierer i vand (det vil sige kun sjældent vil syren miste sin proton H+ til vand). Ligeledes, da konjugatbasen A – er en svag base, stjæler den sjældent en proton h + fra vand.
så forbliver den svage syre og den svage base i opløsningen med høje koncentrationer, da de kun sjældent reagerer med vandet. De reagerer dog meget sandsynligt med enhver tilsat stærk base eller stærk syre.,
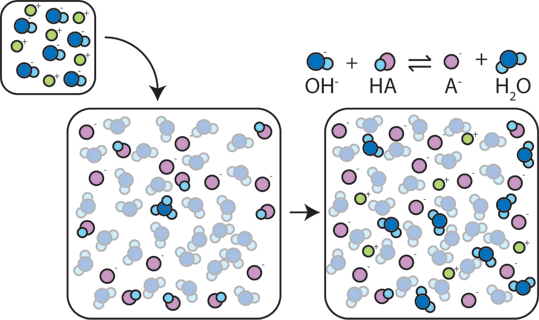
Hvis en stærk base er tilføjet til en buffer, den svage syre vil opgive sin H+ for at omdanne basen (OH-) i vand (H2O) og den konjugerede base: HA + OH- → A- + H2O. Da den ekstra OH – er der forbruges af denne reaktion, vil pH-værdien ændres kun lidt.
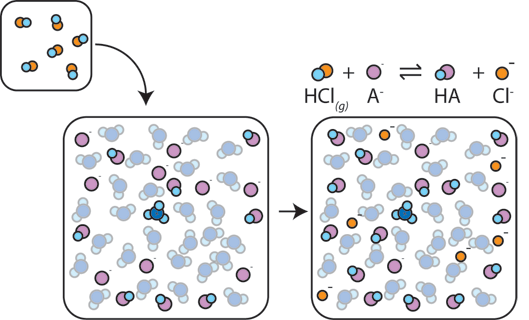
Hvis der tilsættes en stærk syre til en buffer, reagerer den svage base med H+ fra den stærke syre for at danne den svage syre HA: H+ + A – HA HA. H + absorberes af A-i stedet for at reagere med vand for at danne H3O+ (H+), så pH ændres kun lidt.,
Se Næste side for en vejleder, der fører dig gennem de beregninger, der er involveret i at lave en buffer.