jak směs slabé kyseliny a její konjugované báze pomáhá pufrovat roztok proti změnám pH?
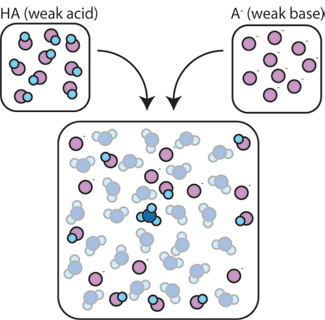
Pokud smícháme slabou kyselinu (HA) s konjugovanou bází (a-), zůstávají v roztoku přítomny jak kyselé, tak bázové složky. Je to proto, že nepodléhají žádným reakcím, které významně mění jejich koncentrace. Kyselina a konjugovaná báze mohou reagovat s navzájem, HA + A- → A- + HA, ale když to dělají tak, že jednoduše vyměnit a koncentrace a nemění se. Kromě toho HA A a-jen zřídka reagují s vodou., Podle definice je slabá kyselina taková, která se jen zřídka disociuje ve vodě (to znamená, že kyselina jen zřídka ztratí svůj proton H+ na vodu). Stejně tak, protože konjugovaná báze A-je slabá báze, zřídka ukradne proton H+ z vody.
slabá kyselina a slabá báze zůstávají v roztoku s vysokými koncentracemi, protože s vodou reagují jen zřídka. Je však velmi pravděpodobné, že budou reagovat s jakoukoli přidanou silnou bází nebo silnou kyselinou.,
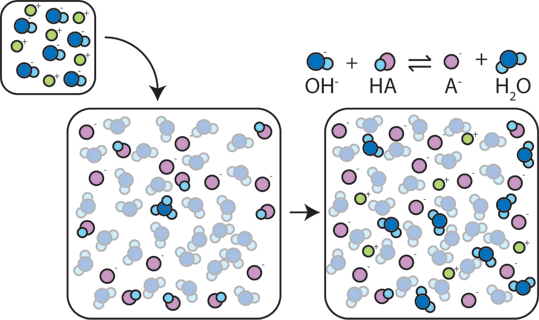
je-Li silný základ je přidán do vyrovnávací paměti, slabé kyseliny se vzdát své H+ s cílem změnit báze (OH-) do vody (H2O) a konjugovaná báze: HA + OH- → A- + H2O. Od přidaných OH – je využívána tato reakce, pH se změní jen mírně.
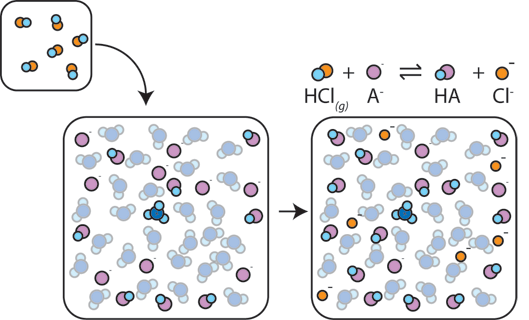
Pokud se do pufru přidá silná kyselina, slabá báze bude reagovat s H + ze silné kyseliny za vzniku slabé kyseliny HA: H+ + A – → HA. H+ se vstřebává A-namísto reakce s vodou za vzniku H3O+ (H+), takže pH se mění jen mírně.,
podívejte se na další stránku pro učitele, který vás vede prostřednictvím výpočtů zapojených do vytváření vyrovnávací paměti.