obiective de învățare
- obțineți o înțelegere a teoriei orbitale moleculare.
- învață să calculezi ordinele de obligațiuni.
- învață să desenezi diagrame de energie de configurare a electronilor orbitali moleculari.teoria legăturii de valență este capabilă să explice multe aspecte ale legăturii, dar nu toate. Pentru a completa această teorie, folosim o alta numită teoria orbitală moleculară (mo)., Teoria orbitală moleculară este un model mai sofisticat pentru înțelegerea naturii legăturii chimice.teoria MO duce ideea de orbitali atomici care se suprapun la un nou nivel, unde noi orbitali moleculari sunt generați folosind un proces matematic numit combinație liniară de orbitali atomici (LCAO).orbitalii moleculari au multe asemănări cu orbitalii atomici:
– sunt umpluți de la cea mai mică energie la cea mai mare energie (principiul Aufbau).
– pot deține maximum doi electroni de spin opus pe orbital (principiul excluderii Pauli).,diferența majoră dintre orbitalii atomici și moleculari este că orbitalii atomici reprezintă densitatea electronică în spațiu asociată cu un anumit atom. Orbitalii moleculari sunt asociați cu întreaga moleculă, ceea ce înseamnă că densitatea electronilor este delocalizată (răspândită) pe mai mult de un atom.
Orbitali Moleculari Moleculei de Hidrogen
Combinarea 1s orbitali din fiecare atom de hidrogen folosind LCAO, doi orbitali moleculari sunt generate σ1s (pronunțat sigma one s) și σ*1s (pronunțat sigma star one s).,orbitalul σ1s este generat de o combinație constructivă (sau interferență), în care cele două funcții ale undelor orbitale atomice se consolidează (se adaugă) reciproc. Aceasta este energia inferioară a celor două orbitale moleculare și este cunoscută sub numele de Orbital molecular de legătură. Observați în figura 9.19 „diagrama combinată orbitală moleculară cu hidrogen” că densitatea electronică a acestui orbital este concentrată între cele două nuclee. Acești electroni sunt stabilizați de atracțiile ambelor nuclee și dețin atomii împreună cu o legătură covalentă.,orbitalul σ * 1S este generat de o combinație distructivă (sau interferență), unde funcțiile de undă ale celor două orbite atomice se anulează reciproc. Acest tip de combinație are ca rezultat o zonă de densitate electronică zero între cele două nuclee, cunoscută sub numele de plan nodal (sau nod). Acest nod de densitate electronică zero se destabilizează spre legătură, făcându-l energie mai mare, iar ulterior acest tip de orbital este cunoscut sub numele de Orbital molecular antibonding (notat cu asteriscul în numele orbital).
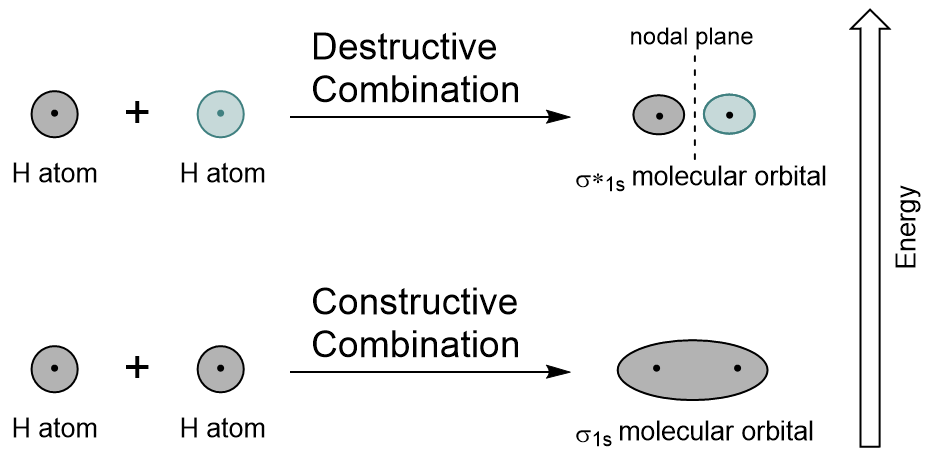
Figura 9.19., Hidrogen molecular orbital combinație diagrama. Similare pentru atomic orbitali, putem scrie configurația electronică a energiei electrice, pentru o orbitali moleculari (Figura 9.20 „Hidrogen molecular orbital configurația electronică a energiei diagrama”). Observați că orbitalii atomici ai fiecărui atom sunt scrise pe ambele părți, iar orbitalii moleculari nou formați sunt scrise în centrul diagramei., Lipirea molecular orbital este umplut și este relativ mai mic de energie decât să contribuie atomica orbitalii, susținând faptul că moleculele de hidrogen (H2) sunt mai stabile decât singuratic atomi de hidrogen.
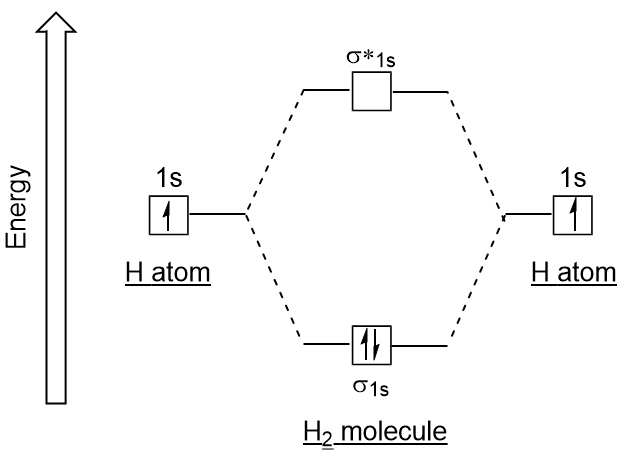
Figura 9.20. Diagrama energiei de configurare a electronilor orbitali moleculari de hidrogen., Pentru Bond
Am văzut că lipirea molecular orbital este mai mic de energie și promovează formarea unei legături covalente, în timp ce antibonding molecular orbital este mai mare de energie, cu un nod de zero densitate de electroni între atomii care destabilizeaza formarea unei legături covalente. Putem evalua puterea unei legături covalente prin determinarea ordinii sale de obligațiuni.
pentru Bond = 1/2 (# de electroni în unire MOs – # de electroni în antibonding MOs)
Bond-pentru valori pot fi numere întregi, fracții, sau zero., Aceste valori corespund modelului de obligațiuni de valență, deci o ordine de obligațiuni de 1 este egală cu o singură legătură, iar 2 este egală cu o legătură dublă. O valoare de zero înseamnă că nu există nicio legătură prezentă, iar atomii există separat.
exemplul 11
determinați ordinea de legătură a moleculei de hidrogen.
Soluție
pentru Bond = 1/2 (# de electroni în unire MOs – # de electroni în antibonding MOs)
pentru Bond = 1/2 (2 – 0) = 1
prin Urmare, există o singură legătură în molecula de hidrogen.,
Orbitali Moleculari de Li2
Generatoare de orbitali moleculari de molecule mai complexe decât hidrogen folosind metoda LCAO necesită următoarele câteva orientări suplimentare:
– numărul de MOs generat este egală cu numărul de orbitali atomici combinate.
– orbitalii atomici combinați ar trebui să aibă niveluri de energie similare.
– eficacitatea combinației orbitale atomice depinde de cantitatea de suprapunere orbitală. Creșterea suprapunerii scade energia orbitalului molecular de legătură și crește energia orbitalului molecular antibonding.,
Să urmați aceste linii directoare și de a genera un orbital molecular de electroni diagrama de configurare pentru Li2 (Figura 9.21 „Molecular orbital configurația electronică a energiei diagrama de dilitiu”):
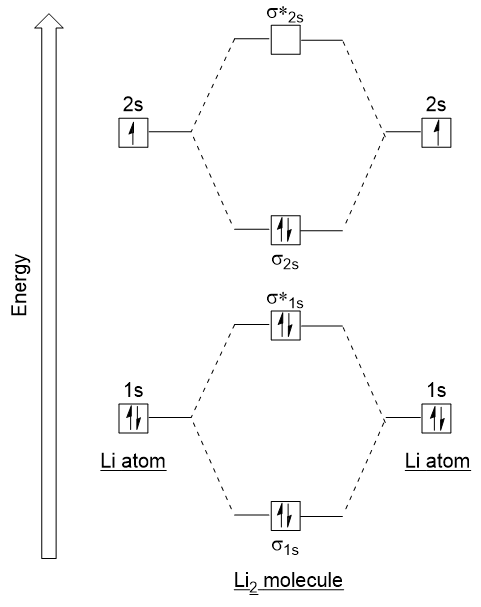
Figura 9.21. Diagrama energiei de configurare a electronilor orbitali moleculari pentru dilitiu. Observați că am combinat 1s atomica orbitalii, ca și mai înainte în H2 exemplu, pentru a genera lipirea și antibonding orbitali moleculari care sunt complet umplute de către ambii atomi’ 1s electroni., În mod similar, orbitalii atomici 2S se combină, dând un orbital de legătură și un orbital antibonding, care sunt umplute cu electronii de valență rămași începând de jos în sus. Orbitalii atomici care se combină au niveluri de energie similare; un orbital 1s nu se combină cu unul dintre orbitalii 2s.ordinea de legătură poate fi determinată pentru ca această moleculă să fie:
ordinea de legătură = 1/2 (4 – 2) = 1prin urmare, Li2 ar avea o singură legătură.,pentru a determina orbitalii moleculari ai multor alte molecule, trebuie să examinăm modul în care orbitalii p se combină pentru a da orbitali moleculari. Orbitalii p se pot suprapune în două moduri: cap-la-cap sau lateral. Cap-la-cap suprapunere de p atomica orbitalii rezultatele într-o unire și antibonding molecular orbital, unde densitatea de electroni este concentrată de-a lungul internuclear axei, ceea ce le face orbitali σ (Figura 9.22 „cap-la-Cap suprapunere de orbitalii p”).
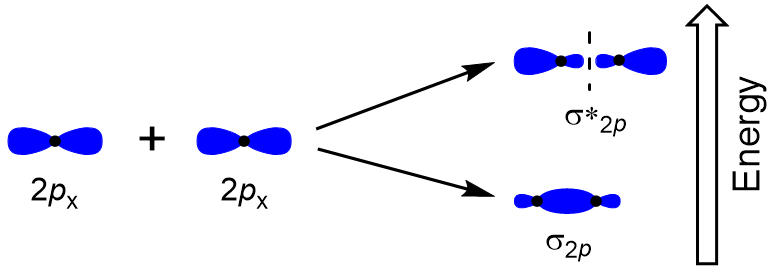
Figura 9.22., Suprapunerea cap-la-cap a orbitalilor P. Lateral suprapunere de restul de patru p atomica orbitalii pot apărea de-a lungul celorlalte două axe, generatoare de patru orbitali moleculari π având densitatea de electroni de pe laturile opuse ale internuclear axei (Figura 9.23 „Lateral suprapunere de orbitalii p”).
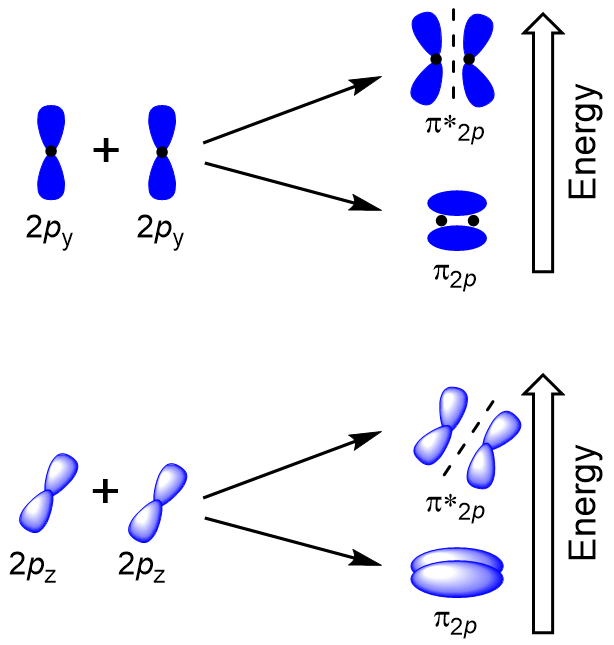
Figura 9.23. Suprapunerea laterală a orbitalilor P., cap-la-cap de suprapunere a da σ orbitali moleculari rezultate din suprapunerea mai mare, ceea ce face lipirea acesteia molecular orbital cel mai stabil și cel mai scăzut de energie, în timp ce σ* antibonding este mai puțin stabilă și are cea mai mare energie (Figura 9.24 „Molecular orbital de energie diagrama pentru homonuclear molecule diatomice făcute din atomi de numărul atomic 8-10”). Suprapunerea laterală dă patru orbitali moleculari π, două orbitali moleculari cu legătură degenerată cu energie inferioară și două orbitali antibondanți cu energie superioară.,
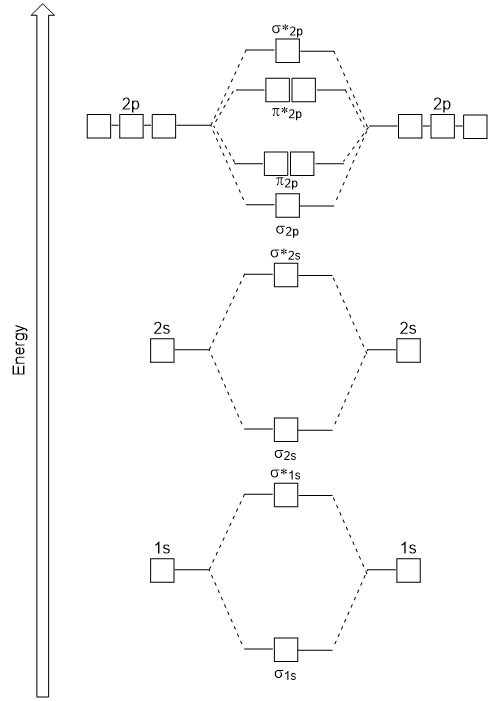
Figura 9.24. Diagrama energiei orbitale moleculare pentru moleculele diatomice homonucleare realizate din atomi cu numărul atomic 8-10. energia diagrama ne-au generat se potrivește experimental cu O2, F2, și Ne2, dar nu se încadrează pentru B2, C2, și N2. În cele din urmă, homonuclear molecule diatomice (B2, C2, și N2), interacțiuni au loc între 2s și 2p atomica orbitalii care sunt suficient de puternice pentru a schimba comanda de σ2p și n2p orbitali moleculari (Figura 9.25).,
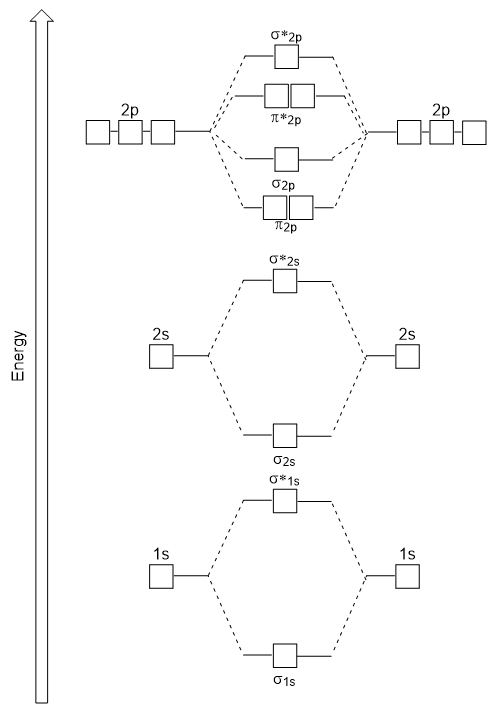
Figura 9.25. Diagrama energiei orbitale moleculare pentru moleculele diatomice homonucleare realizate din atomi cu numărul atomic 5-7. Heteronucleari Molecule Diatomice
În heteronucleari molecule diatomice, în cazul în care două molecule diferite sunt lipite, nivelurile de energie ale atomilor individuali’ atomica orbitalii poate diferi. Cu toate acestea, diagrama orbitală moleculară vedem în Figura 9.,25 („Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 5-7”) poate fi folosit pentru a estima configurația de electroni și ordinea de obligațiuni.
Frontieră Orbitali Moleculari
Ne putem concentra în continuare asupra a două foarte importante tipuri de orbitali moleculari: cel mai înalt ocupat molecular orbital (HOMO) și cea mai mică neocupate molecular orbital (LUMO), de asemenea, denumite colectiv frontiera orbitali moleculari (Figura 9.26 „Frontieră orbitali moleculari HOMO și LUMO”)., Ca numele lor implică, HOMO este molecular orbital care are cea mai mare energie și conține electroni, în timp ce LUMO este mai mic de energie molecular orbital care nu conține electroni.
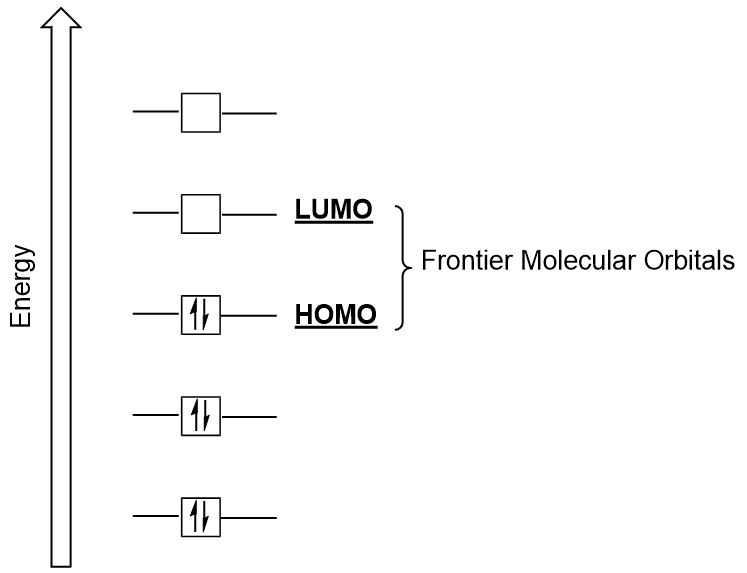
Figura 9.26. Frontier molecular orbitals HOMO și LUMO. atunci Când moleculele absorb energie, este tipic pentru un HOMO electron pentru a utiliza această energie pentru trecerea de la sol HOMO orbital la LUMO entuziasmat-de stat orbital., Acest tip de tranziție poate fi observat în experimentele de spectroscopie a radiațiilor ultraviolete vizibile (UV-Vis). De asemenea, în multe reacții chimice, o moleculă de reactant poate dona electroni HOMO LUMO unui alt reactant (figura 9.27 „formarea unui nou orbital molecular de legătură prin combinarea reactantului HOMO și LUMO”). Prin urmare, înțelegerea nivelurilor de energie orbitală moleculară de Frontieră poate oferi chimiștilor o mare perspectivă în domeniile spectroscopiei moleculare și reactivității.
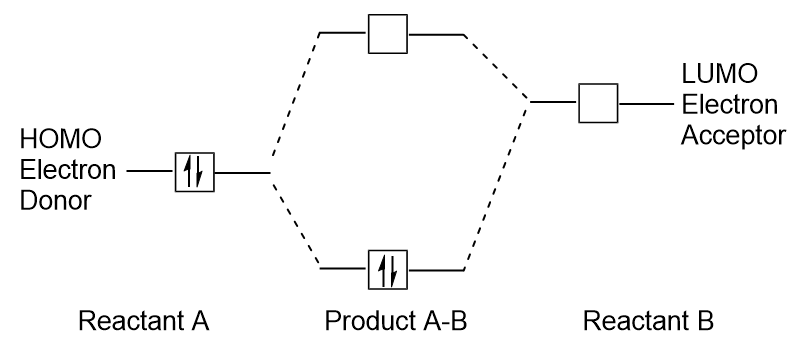
Figura 9.27., Formarea unui nou orbital molecular de legătură prin combinarea reactantului HOMO și LUMO. Takeaways Cheie
- Atomica orbitalii pot combina pentru a face lipirea și antibonding orbitali moleculari.
- Orbitalii de legătură sunt mai mici în energie decât orbitalii antibonding.
- orbitalii moleculari sunt umpluți folosind principii similare orbitalilor atomici.
- ordinea obligațiunilor poate fi utilizată pentru a evalua puterea obligațiunilor.
- orbitalii moleculari de Frontieră au o importanță deosebită în spectroscopia moleculară și reactivitate.