Learning Objectives
- Gain an understanding of molecular orbital theory.
- Aprenda a calcular ordens de obrigações.
- Aprenda a desenhar diagramas de energia de configuração molecular orbital de elétrons.
a teoria da ligação de Valência é capaz de explicar muitos aspectos da ligação, mas não todos. Para complementar esta teoria, usamos outra chamada teoria orbital molecular (MO)., A teoria Molecular orbital é um modelo mais sofisticado para entender a natureza da ligação química.a teoria de MO leva a ideia de orbitais atômicos sobrepostos a um novo nível, onde novos orbitais moleculares são gerados usando um processo matemático chamado combinação linear de orbitais atômicos (LCAO).orbitais moleculares compartilham muitas semelhanças com orbitais atômicos:
– eles são cheios da menor energia para a maior energia (princípio de Aufbau).
– eles podem conter um máximo de dois elétrons de spin oposto por orbital (princípio de exclusão de Pauli).,
A principal diferença entre orbitais atômicos e moleculares é que orbitais atômicos representam a densidade de elétrons no espaço associado a um átomo particular. Orbitais moleculares são associados com a molécula inteira, o que significa que a densidade de elétrons é deslocalizada (espalhada) sobre mais de um átomo.
Os Orbitais Moleculares da Molécula de Hidrogénio
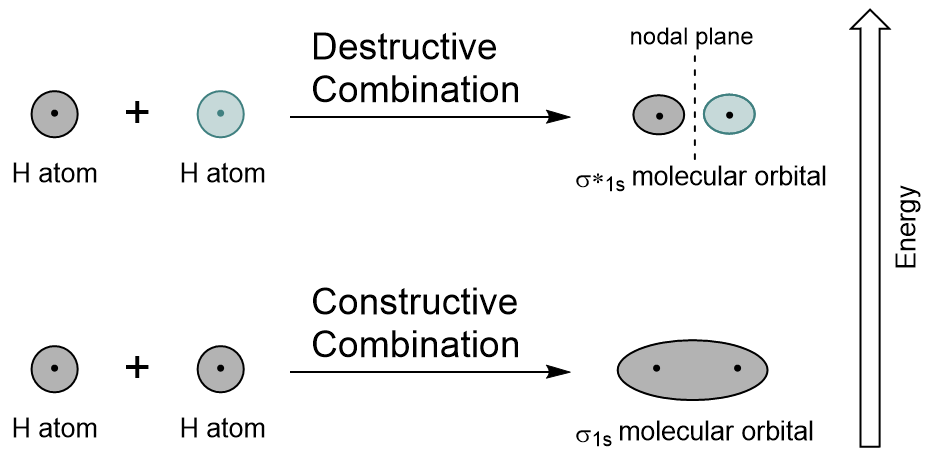
a Combinação de 1s orbitais de cada átomo de hidrogênio usando LCAO, dois orbitais moleculares são gerados σ1s (pronuncia-sigma s) e σ*1s (pronuncia-sigma star one s).,
o orbital σ1s é gerado por uma combinação construtiva (ou interferência), onde as duas funções orbitais atômicas de onda reforçam-se mutuamente. Esta é a menor energia dos dois orbitais moleculares e é conhecida como a ligação orbital molecular. Notice in Figure 9.19 “Hydrogen molecular orbital combination diagram” that the electron density of this orbital is concentrated between the two nuclei. Estes elétrons são estabilizados por atrações de ambos os núcleos, e eles mantêm os átomos juntos com uma ligação covalente.,
O σ * 1s orbital é gerado por uma combinação destrutiva (ou interferência), onde as funções de onda dos dois orbitais atômicos cancelam um ao outro. Este tipo de combinação resulta em uma área de densidade de elétrons zero entre os dois núcleos, conhecido como plano nodal (ou nó). Este nó de densidade de elétrons zero está desestabilizando em direção à ligação, tornando-se maior energia, e subsequentemente este tipo de orbital é conhecido como um orbital molecular antibonding (denotado pelo asterisco no nome orbital).
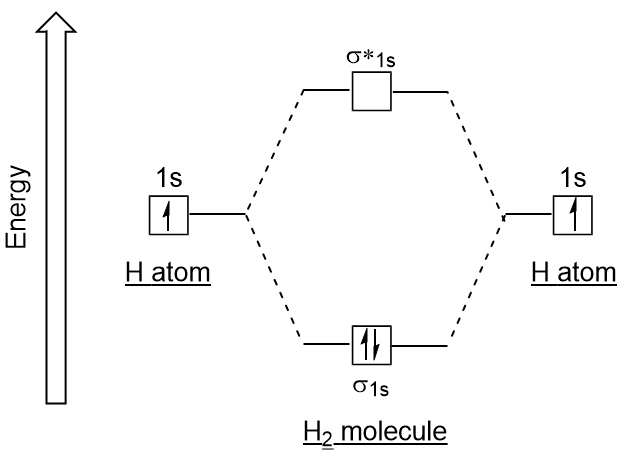
Similar aos orbitais atômicos, podemos escrever diagramas de energia de configuração eletrônica para orbitais moleculares (figura 9.20 “Diagrama de configuração molecular de elétrons de hidrogênio”). Note que os orbitais atômicos de cada átomo são escritos em ambos os lados, e os orbitais moleculares recém-formados são escritos no centro do diagrama., O orbital molecular de ligação é preenchido e é relativamente menor em energia do que os orbitais atômicos que contribuem, suportando o fato de que as moléculas de hidrogênio (H2) são mais estáveis do que os átomos de hidrogênio solitário.
Bond Ordem
já vimos que a ligação orbital molecular é menor consumo de energia e promove a formação de uma ligação covalente bond, enquanto o antibonding orbital molecular é maior de energia com um nó de zero densidade de elétrons entre os átomos que desestabiliza a formação de uma ligação covalente bond. Podemos avaliar a força de uma ligação covalente determinando a sua ordem de ligação.
Bond order = 1/2 (# of electrons in bonding MOs – # of electrons in antibonding MOs)
Bond-order values can be whole numbers, fractions, or zero., Estes valores correspondem ao modelo de ligação de valência, de modo que uma ordem de ligação de 1 é igual a uma única ligação, e 2 é igual a uma ligação dupla. Um valor de zero significa que não há ligação presente, e os átomos existem separadamente.
exemplo 11
determina a ordem de ligação da molécula de hidrogénio.
solução
ordem de ligação = 1/2 (# de electrões na ligação MOs – # de electrões em MOs antibonding MOs)
ordem de ligação = 1/2 (2 – 0) = 1
portanto, existe uma ligação única na molécula de hidrogénio.,
Orbitais Moleculares de Li2
a Geração de orbitais moleculares de moléculas mais complexas do que o hidrogênio utilizando o método LCAO requer a seguir algumas diretrizes adicionais:
– O número de MOs gerado é igual ao número de orbitais atómicas combinado.os orbitais atómicos combinados devem ter níveis de energia semelhantes.
– a eficácia da combinação orbital atômica depende da quantidade de sobreposição orbital. O aumento da sobreposição reduz ainda mais a energia do orbital molecular de ligação, e aumenta a energia do orbital molecular antibonding.,
Let’s follow these guidelines and generate a molecular orbital electron configuration diagram for Li2 (Figure 9.21 “Molecular orbital electron configuration Energy diagram for dilithium”):
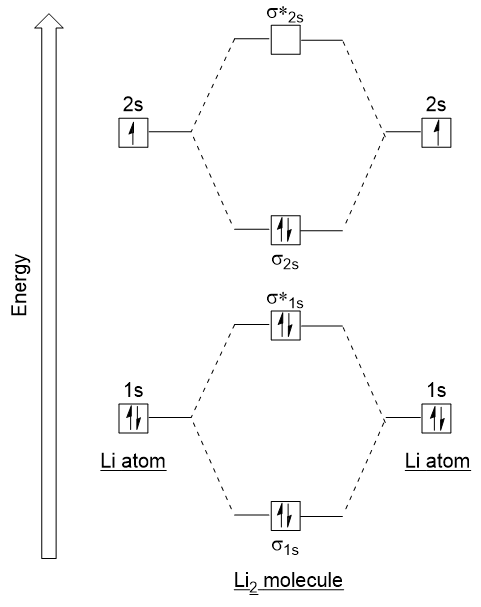
Aviso de que combinado a 1s orbitais atómicas, como antes no H2 exemplo, para gerar o vínculo e antibonding orbitais moleculares que são completamente preenchida por ambos os átomos de ” 1s elétrons., Similarmente orbitais atômicos 2s se combinam, dando um orbital de ligação e um orbital antibonding, que são preenchidos com os elétrons de Valência restantes começando a partir de baixo para cima. Os orbitais atômicos que se combinam são de níveis de energia semelhantes; um orbital 1s não se combina com um dos orbitais 2s.
a ordem de ligação pode ser determinada para que esta molécula seja:
ordem de ligação = 1/2 (4 – 2) = 1
portanto Li2 teria uma única ligação.,
orbitais moleculares de p orbitais atômicos
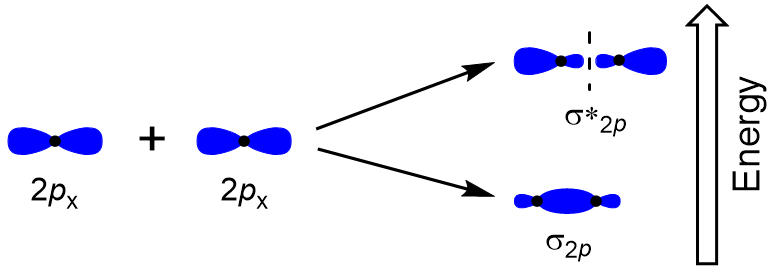
para determinar os orbitais moleculares de muitas outras moléculas, precisamos examinar como os orbitais p se combinam para dar orbitais moleculares. Os orbitais p podem se sobrepor de duas maneiras: cabeça-a-cabeça ou lateral. Head-to-Head sobreposição de p orbitais atómicas, resulta em uma ligação e antibonding orbital molecular, onde a densidade de elétrons é centrada ao longo do eixo internuclear, tornando-os orbitais σ (Figura 9.22 “Cabeça-a-cabeça sobreposição de orbitais p”).
sobreposição lateral dos restantes quatro orbitais atômicos p pode ocorrer ao longo dos outros dois eixos, gerando quatro orbitais moleculares π Com densidade de elétrons em lados opostos do eixo internuclear (figura 9.23 “sobreposição lateral dos orbitais p”).
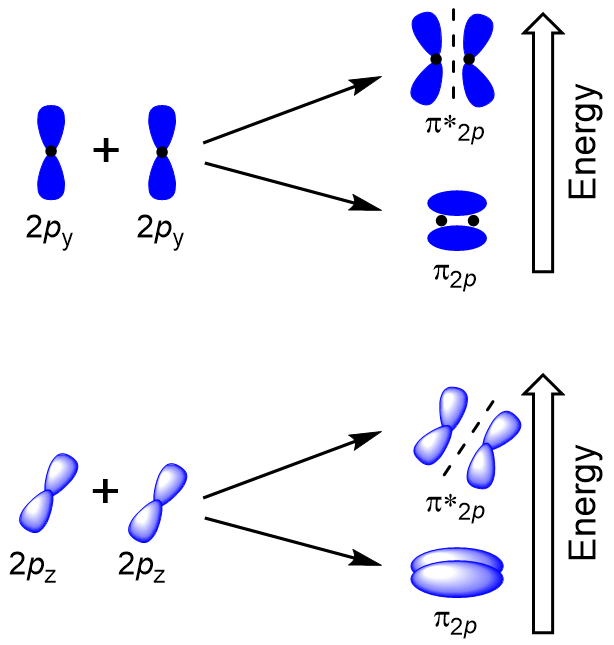
O cabeça-de-cabeça se sobrepõem dando σ orbitais moleculares resulta em maior sobreposição, fazendo a sua ligação orbital molecular mais estáveis e de menor energia, enquanto o σ* antibonding é menos estável e a mais alta energia (Figura 9.24 “orbital Molecular diagrama de energia para homonuclear moléculas moléculas feitas de átomos de número atômico 8-10”). A sobreposição lateral dá quatro orbitais moleculares π, dois orbitais moleculares degenerados de baixa energia e dois orbitais antibonding de alta energia.,
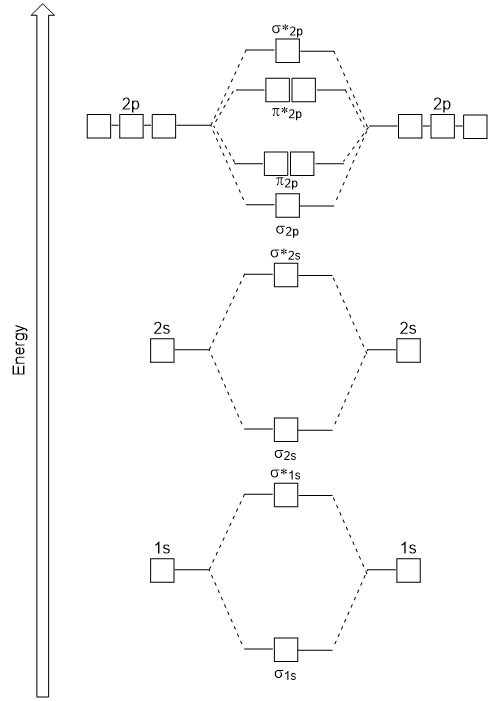
o diagrama de energia que acabamos de gerar encaixa experimentalmente com O2, F2, e Ne2, mas não cabe para B2, C2, e N2. Neste último, moléculas diatômicas homonucleares (B2, C2 e N2), interações ocorrem entre os orbitais atômicos 2s e 2p que são fortes o suficiente para trocar a ordem dos orbitais moleculares σ2p e n2p (figura 9,25).,
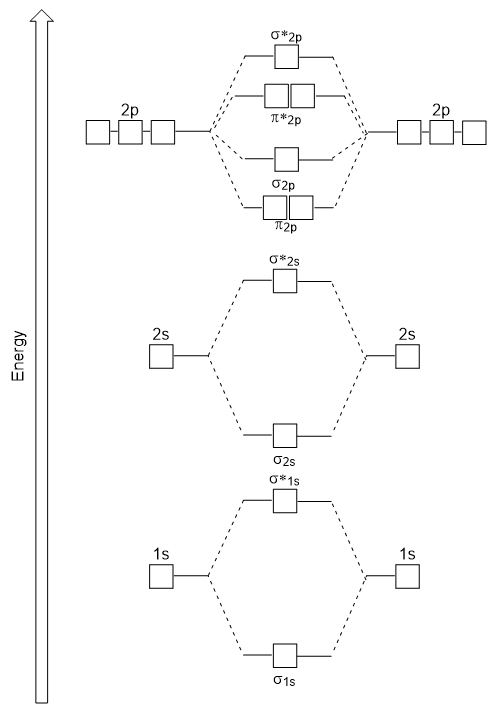
Heteronuclear Moléculas Moléculas
Em heteronuclear moléculas de moléculas, onde duas moléculas diferentes são ligados, os níveis de energia dos átomos individuais’ orbitais atómicas podem ser diferentes. No entanto, o diagrama orbital molecular que vemos na Figura 9.,25 (“Molecular orbital Energy diagram for homonuclear diatomic molecules made from atoms of atomic number 5-7”) can be used to estimate the electron configuration and bond order.
Fronteira Orbitais Moleculares
podemos nos concentrar mais em dois importantes tipos de orbitais moleculares: a mais alta orbital molecular ocupado (HOMO) e o menor orbital molecular desocupado (LUMO), também referidos coletivamente como a fronteira orbitais moleculares (Figura 9.26 “Fronteira orbitais moleculares HOMO e LUMO”)., Como seus nomes indicam, o HOMO é a orbital molecular que tem a maior energia e contém elétrons, enquanto o LUMO é a menor energia orbital que não contém elétrons.
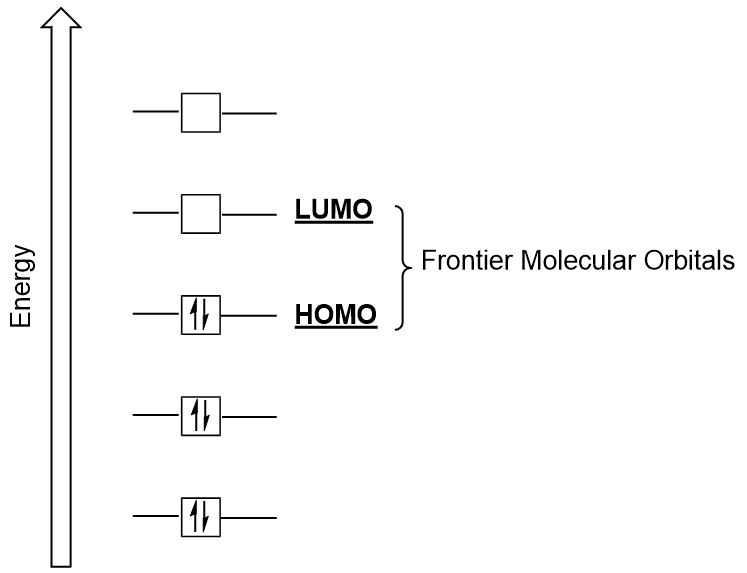
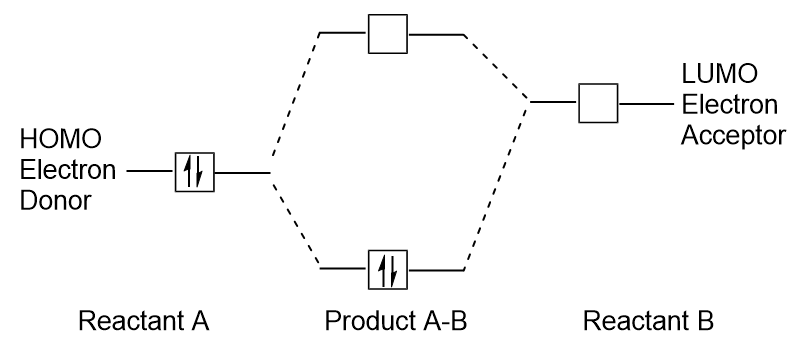
When molecules absorb energy, it is typical for a HOMO electron to use this energy to transition from the ground HOMO orbital to the LUMO excited-state orbital., Este tipo de transição pode ser observado em experimentos de espectroscopia de radiação ultravioleta-visível (UV-Vis). Além disso, em muitas reações químicas, uma molécula reagente pode doar elétrons HOMO para o LUMO de outro reagente (figura 9.27 “formação de uma nova ligação orbital molecular combinando o reagente HOMO e LUMO”). Portanto, compreender os níveis de energia orbital molecular frontier pode fornecer aos químicos uma grande quantidade de conhecimento nas áreas de espectroscopia molecular e reatividade.
Key Takeaways
- Atomic orbitals can combine to make bonding and antibonding molecular orbitals.os orbitais de ligação são mais baixos em energia do que os orbitais antibonding.orbitais moleculares são preenchidos usando princípios similares aos orbitais atômicos.a ordem de ligação pode ser usada para avaliar a força de ligação.orbitais moleculares de fronteira são de particular importância na espectroscopia molecular e reatividade.