lärandemål
- få förståelse för molekylär orbitalteori.
- lär dig att beräkna obligationsorder.
- lär dig att rita molecular orbital electron configuration energy diagram.
Valence bond theory kan förklara många aspekter av bindning, men inte alla. För att komplettera denna teori använder vi en annan som kallas molecular orbital (MO) teorin., Molekylär orbital teori är en mer sofistikerad modell för att förstå vilken typ av kemisk bindning.
mo teori tar idén om atomära orbitaler överlappande till en ny nivå, där nya molekylära orbitaler genereras med hjälp av en matematisk process som kallas linjär kombination av atomära orbitaler (LCAO).
molekylära orbitaler delar många likheter med atomiska orbitaler:
– de fylls från lägsta energi till högsta energi (Aufbau-principen).
– de kan hålla högst två elektroner av motsatt spinn per orbital (Pauli exclusion principle).,
den stora skillnaden mellan atomära och molekylära orbitaler är att atomiska orbitaler representerar elektrondensitet i rymden i samband med en viss atom. Molekylära orbitaler är associerade med hela molekylen, vilket betyder att elektrondensiteten delokaliseras (sprids ut) över mer än en atom.
Vätemolekylens molekylära orbitaler
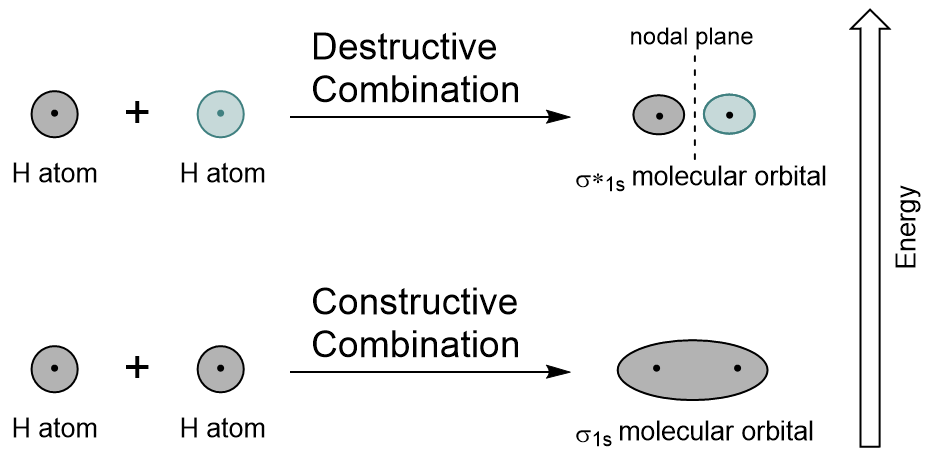
genom att kombinera 1s-orbitalerna i varje väteatom med LCAO genereras två molekylära orbitaler σ1s (uttalad sigma one s) och σ*1s (uttalad sigma star one s).,
σ1s orbital genereras av en konstruktiv kombination (eller interferens), där de två atomära orbitalvågfunktionerna förstärker (lägger till) varandra. Detta är den lägre energin i de två molekylära orbitalerna och är känd som bindning molekylära orbital. Lägg märke till i Figur 9.19 ”väte molecular orbital combination diagram” att elektrondensiteten hos denna orbital är koncentrerad mellan de två kärnorna. Dessa elektroner stabiliseras av attraktioner till båda kärnorna, och de håller atomerna tillsammans med en kovalent bindning.,
σ * 1s orbital genereras av en destruktiv kombination (eller störning), där vågfunktionerna hos de två atomiska orbitalerna avbryter varandra. Denna typ av kombination resulterar i ett område med noll elektrondensitet mellan de två kärnorna, känd som ett nodplan (eller nod). Denna nod med noll elektrondensitet destabiliserar mot bindningen, vilket gör den högre energi, och därefter är denna typ av orbital känd som en antibonding molekylär orbital (betecknad med asterisken i orbitalnamnet).
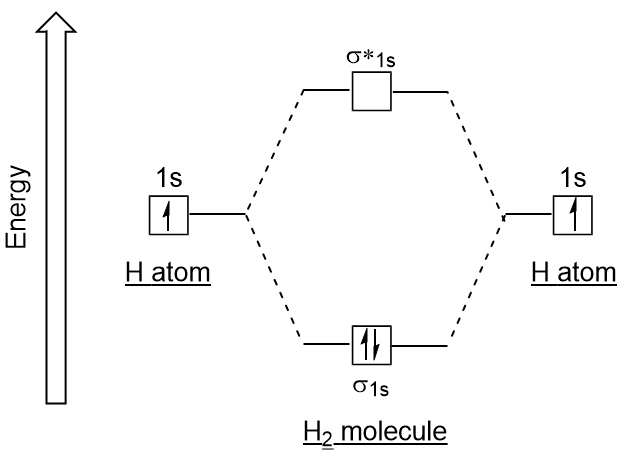
i likhet med atomära orbitaler kan vi skriva elektronkonfigurationsenergidiagram för molekylära orbitaler (figur 9.20 ”hydrogen molecular orbital electron configuration energy diagram”). Observera att de atomära orbitalerna i varje atom är skrivna på vardera sidan, och de nybildade molekylära orbitalerna är skrivna i mitten av diagrammet., Bindningsmolekylära orbital fylls och är relativt lägre i energi än de bidragande atomiska orbitalerna, som stöder det faktum att vätemolekyler (H2) är stabilare än lone väteatomer.
Bond Beställning
Vi har bara sett att bindning molekylär orbital är lägre energi och främjar bildandet av en kovalent bindning, medan antibonding molekylär orbital är högre energi med en nod noll elektrontätheten mellan de atomer som destabiliserar bildandet av en kovalent bindning. Vi kan utvärdera styrkan hos en kovalent obligation genom att bestämma dess obligationsordning.
Bond order = 1/2 (#av elektroner i bindning MOs – # av elektroner i antibonding MOs)
Bond-ordervärden kan vara heltal, fraktioner eller noll., Dessa värden motsvarar valutabindningsmodellen, så en obligationsorder på 1 är lika med en enda bindning och 2 är lika med en dubbelbindning. Ett värde på noll innebär att det inte finns någon bindning närvarande, och atomerna finns separat.
exempel 11
Bestäm vätemolekylens bindningsordning.
lösning
Bond order = 1/2 (#av elektroner i bindning MOs – # av elektroner i antibonding MOs)
Bond order = 1/2 (2 – 0) = 1
därför finns det en enda bindning i vätemolekylen.,
molekylära orbitaler av Li2
generering av molekylära orbitaler av molekyler mer komplexa än väte med lcao– metoden kräver att man följer några ytterligare riktlinjer:
– antalet genererade MOs är lika med antalet atomiska orbitaler kombinerade.
– kombinerade atomiska orbitaler bör ha liknande energinivåer.
– effektiviteten av atomic orbital kombination beror på mängden orbital överlappning. Ökad överlappning sänker energin i bindningsmolekylära orbital ytterligare, och höjer energin i den antibonding molekylära orbital.,
låt oss följa dessa riktlinjer och skapa ett molecular orbital electron configuration diagram för Li2 (figur 9.21 ”Molecular orbital electron configuration energy diagram för dilithium”):
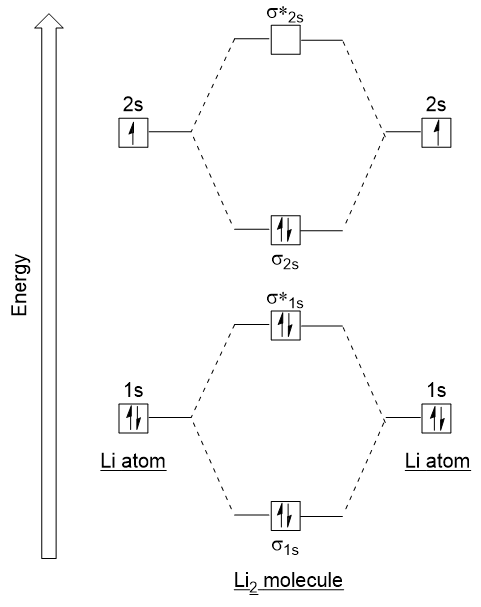
Observera att vi har kombinerat 1s atomiska orbitaler, som tidigare i H2-exemplet, för att generera bindning och antibonding molekylära orbitaler som är helt fyllda av båda atomernas 1s elektroner., På samma sätt kombinerar 2s atomiska orbitaler, vilket ger en bindningsbana och en antibonding orbital, som är fyllda med de återstående valenselektronerna från botten uppåt. Atom orbitaler som kombinerar är av liknande energinivåer; en 1s orbital kombinerar inte med en av 2s orbitaler.
bondordningen kan bestämmas för att denna molekyl ska vara:
Bondordning = 1/2 (4 – 2) = 1
därför skulle Li2 ha en enda obligation.,
molekylära orbitaler från P atomiska orbitaler
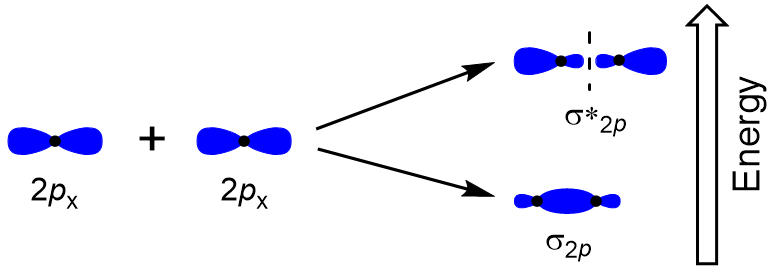
för att bestämma molekylära orbitaler hos många andra molekyler måste vi undersöka hur p orbitaler kombinerar för att ge molekylära orbitaler. P-orbitalerna kan överlappa på två sätt: huvud till huvud eller sidled. Head-to-head överlappning av p atomiska orbitaler resulterar i en bindning och antibonding molekylär orbital, där elektrondensiteten är centrerad längs internuclear axeln, vilket gör dem σ orbitaler (figur 9.22 ”Head-to-head överlappning av p orbitaler”).
sidledes överlappning av de återstående fyra P atomiska orbitaler kan förekomma längs de två andra axlarna, generera fyra π molekylära orbitaler med elektrondensitet på motsatta sidor av den internucleära axeln (figur 9.23 ”sidledes överlappning av p-orbitaler”).
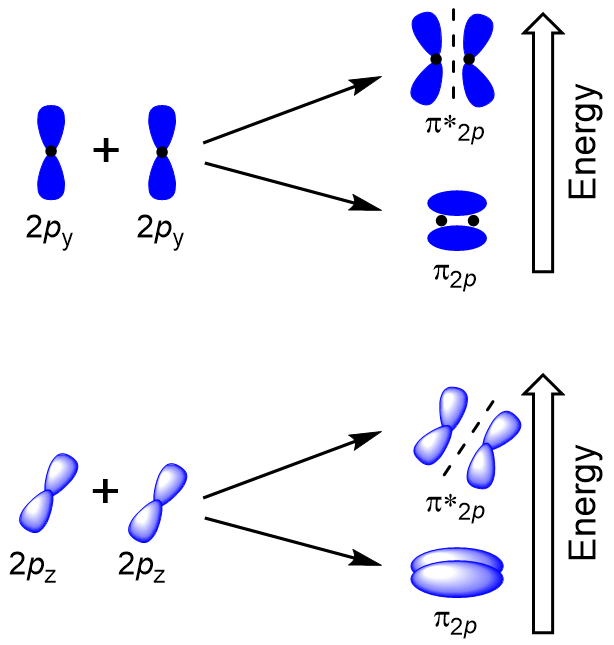
överlappningen från huvud till huvud ger σ molekylära orbitaler resulterar i större överlappning, vilket gör dess bindningsmolekylära orbital den mest stabila och lägsta energin, medan σ* antibonding är minst stabil och har den högsta energin (figur 9.24 ”Molecular orbital Energy diagram för homonukleära diatomiska molekyler gjorda av atomer med atomnummer 8-10”). Sidledes överlappning ger fyra π molekylära orbitaler, två lägre energi degenererade bindningsmolekylära orbitaler och två högre energi antibonding orbitaler.,
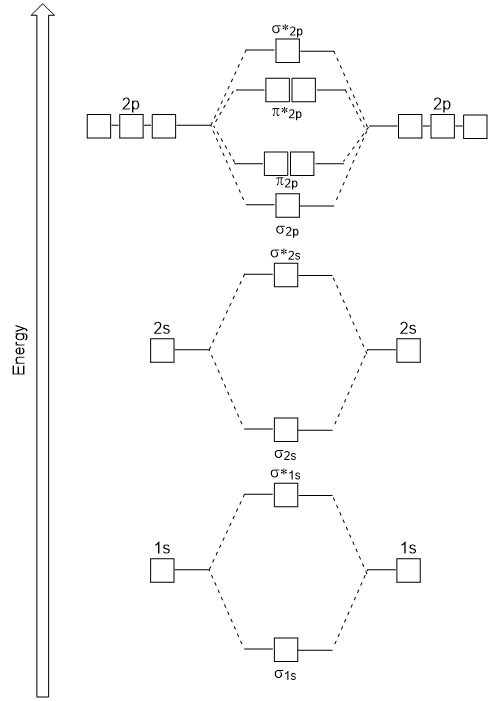
energidiagrammet vi just har genererat passar experimentellt med O2, F2 och Ne2, men passar inte för B2, C2 och N2. I det senare, homonukleära diatomiska molekyler (B2, C2 och N2), sker interaktioner mellan 2s och 2P atomiska orbitaler som är tillräckligt starka för att byta beställning av σ2p och n2p molekylära orbitaler (figur 9.25).,
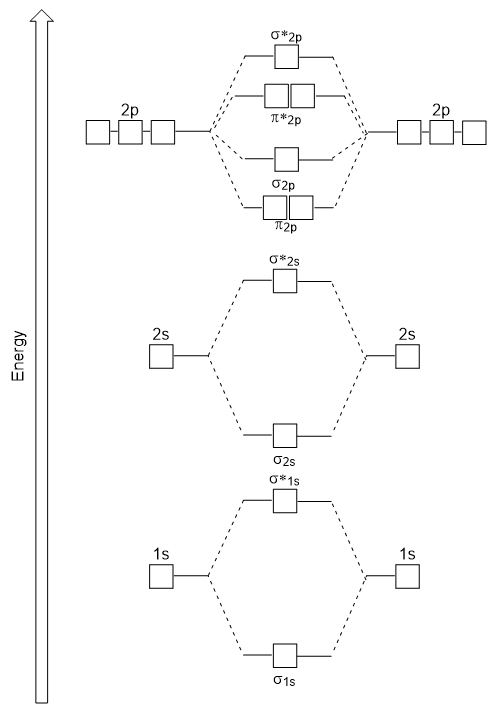
Heteronukleära Diatomära molekyler
i heteronukleära diatomära molekyler, där två olika molekyler är bundna, kan energinivåerna hos de enskilda atomernas atomiska orbitaler skilja sig. Men det molekylära orbitaldiagrammet vi ser i Figur 9.,25 (”Molecular orbital Energy diagram för homonukleära diatomiska molekyler gjorda av atomer av atomnummer 5-7”) kan användas för att uppskatta elektronkonfigurationen och bindningsordningen.
Gränsmolekylära orbitaler
Vi kan fokusera vidare på två mycket viktiga typer av molekylära orbitaler: den högsta ockuperade molekylära orbitalen (HOMO) och den lägsta obesatta molekylära orbitalen (LUMO), även kallad gränsmolekylära orbitaler (figur 9.26 ”gränsmolekylära orbitaler HOMO och LUMO”)., Som deras namn antyder, HOMO är den molekylära orbital som har den högsta energin och innehåller elektroner, medan LUMO är den lägsta energimolekylära orbital som inte innehåller elektroner.
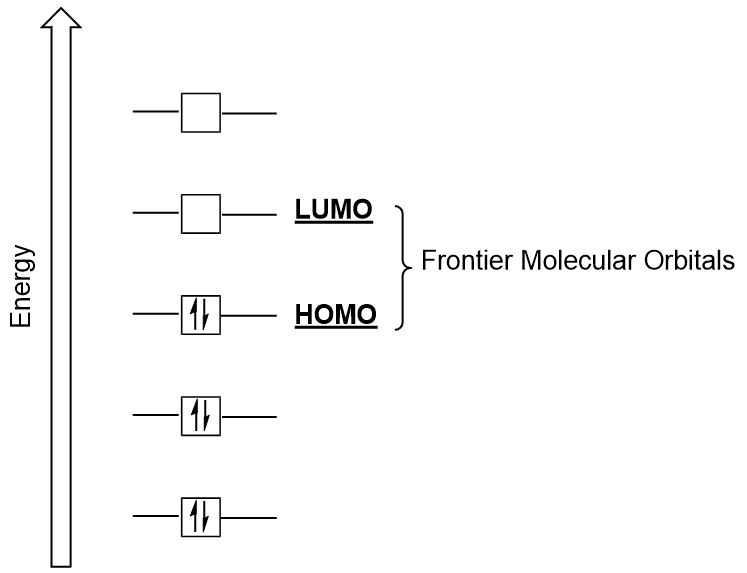
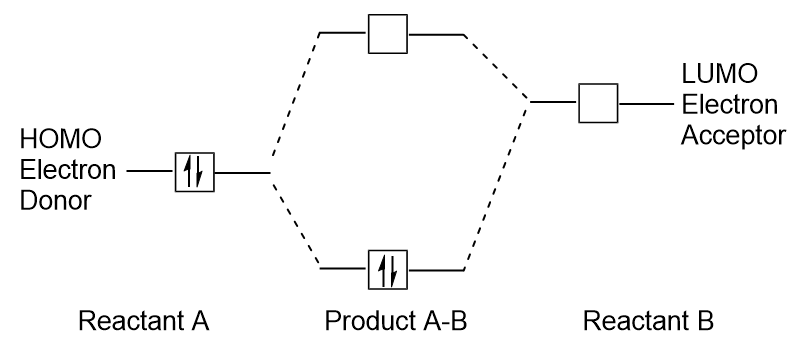
när molekyler absorberar energi är det typiskt för en HOMO-elektron att använda denna energi för att övergå från marken HOMO-orbital till Lumo excited-state orbital., Denna typ av övergång kan observeras i ultravioletta synliga (UV-Vis) strålningsspektroskopi experiment. Även i många kemiska reaktioner kan en reaktantmolekyl donera HOMO-elektroner till LUMO av ett annat reaktant (figur 9.27 ”bildning av en ny bindningsmolekylär orbital genom att kombinera reactant HOMO och LUMO”). Därför kan förståelse av gränsmolekylära orbitala energinivåer ge kemister stor insikt inom områdena molekylär spektroskopi och reaktivitet.
viktiga Takeaways
- atomiska orbitaler kan kombinera för att göra bindning och antibonding molekylära orbitaler.
- bindning orbitaler är lägre i energi än antibonding orbitaler.
- molekylära orbitaler fylls med liknande principer som atomära orbitaler.
- Bond order kan användas för att utvärdera bond styrka.
- gränsmolekylära orbitaler är av särskild betydelse för molekylär spektroskopi och reaktivitet.