US Pharm. 2020;45(9):27-29.rezumat: deoarece hormonii sintetici au fost combinați pentru prima dată în anii 1940, terapia de substituție hormonală a fost utilizată pe scară largă de femeile care suferă de simptome nedorite de menopauză. Cercetările ulterioare au condus la descoperirea mai multor efecte negative asociate cu utilizarea terapiei hormonale, ceea ce a dus la discuții cu privire la riscurile versus beneficiile tratamentului hormonal., Din cauza riscurilor asociate cu preparate comerciale, terapia cu hormoni compuse (CHT) a devenit mai proeminent, așa cum a fost touted ca o alternativă biologic echivalent cu hormoni sintetici. Cu toate acestea, din cauza unei supravegheri minime până la nici o supraveghere FDA în domeniul compoundării, în general, CHT poate să nu fie la fel de sigur cum a fost anunțat. În 2018, pe baza rezultatelor favorabile ale studiului, Bijuva a devenit prima combinație bioidentică aprobată de FDA 17-beta estradiol-progesteron.,de zeci de ani, femeile au apelat la terapia de substituție hormonală pentru a trata simptomele vasomotorii adverse asociate menopauzei, cum ar fi bufeurile și transpirațiile nocturne. Femeile pot petrece până la o treime din viața lor într-o stare cu deficit de hormoni, ceea ce contribuie în continuare la astfel de efecte nedorite, cum ar fi schimbările de dispoziție, riscul crescut de osteoporoză și scăderea libidoului. Estrogenul sistemic este cel mai eficient tratament pentru simptomele vasomotorii, în timp ce simptomele genitourinare asociate menopauzei trebuie tratate cu doze mici de estrogen topic.,1 studiul observațional al Sănătății Femeilor din întreaga națiune a constatat că femeile prezintă simptome vasomotorii pentru o medie de 7, 4 ani după menopauză.2 cu toate acestea, majoritatea clinicienilor recomandă ca tratamentul să nu dureze mai mult de 5 ani după menopauză și recomandă cu tărie evitarea terapiei hormonale cu totul la femeile cu vârsta peste 60 de ani.1 clinicianul trebuie să cântărească cu atenție riscurile și beneficiile asociate hormonilor sintetici și compuși, ținând cont în același timp de obiectivul principal de îmbunătățire a calității vieții pacientului.,
Hormoni Bioidentici
hormoni Bioidentici, cum ar fi estrogeni, progesteron și androgeni, sunt compuși care sunt preparate în conformitate cu USP Capitolul <795> Nesterile Compunere standarde. Acești hormoni pot fi compuse într-o varietate de doze și forme de dozare, creând mai multe opțiuni pentru femeile interesate de terapie cu hormoni compuse (CHT)., Agravată formulări nu sunt supuse stricte de fabricație și a standardelor de puritate testarea lor FDA-aprobat omologii face; cu toate acestea, în ciuda acestui mediu nereglementat, CHT este foarte popular cu pacientii care doresc mai „personalizate” medicină.Societatea endocrină a definit hormonii bioidentici compuși ca ” compuși care au exact aceeași structură chimică și moleculară ca hormonii care sunt produși în corpul uman.,”3 FDA afirmă că termenul de hormon bioidentic este pur și simplu o strategie de marketing, deoarece nu există o bază științifică pentru un beneficiu implicit sau o reducere a riscului pentru CHT față de terapia hormonală sintetică aprobată de FDA.3
terapia cu hormoni sintetici
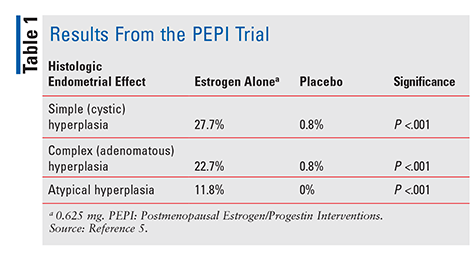
FDA a aprobat dietilstilbestrolul în 1941 și estrogenii ecvini conjugați (CEE) în 1942 pentru a trata simptomele menopauzei.4 începând cu anii 1960, vânzările de estrogen au crescut până în 1975, când au apărut rapoarte că utilizarea estrogenului ar putea fi asociată cu un risc crescut de cancer endometrial.,4 Cu toate acestea, aceste rapoarte au fost în mare parte ignorate, iar utilizarea estrogenului a continuat. Nu până în 1996, când a fost publicat studiul intervențiilor de Estrogen/Progestin postmenopauză (PEPI), furnizorii de asistență medicală au început să înțeleagă cu adevărat potențialele efecte negative asociate terapiei cu estrogen. PEPI a fost un studiu randomizat, controlat cu placebo, dublu-orb, multicentric, cu durata de 3 ani, care a examinat efectele endometriale histologice ale terapiei cu estrogen sintetic fără opoziție comparativ cu trei regimuri diferite de estrogen sintetic plus progestin.,5
În PEPI proces, în mod semnificativ mai multe subiecte dat estrogen singur dezvoltat simple, complexe, sau hiperplaziei endometriale atipice comparativ cu subiecții care au primit placebo (TABELUL 1). În plus, în timp ce procentele exacte nu au fost specificate, ratele de hiperplazie la subiecții care au primit unul din cele trei estrogen plus progesteron regimuri au fost similare cu cele din subiecți s-a administrat placebo.5 în rezumat, administrarea de estrogen singur la o doză de 0.,625 mg pe zi au dus la o incidență semnificativ crescută a hiperplaziei endometriale, în timp ce combinarea ECE cu progestin a protejat endometrul de supraaglomerare într-o măsură considerabilă.5 din cauza acestui risc dovedit de cancer endometrial, progestinul este administrat întotdeauna în combinație cu estrogenul la femeile cu uter intact. Confirmând în continuare acest risc, o serie de cazuri din 2007 a descris trei femei care au utilizat CHT conținând doze subterapeutice de progestin și ulterior au dezvoltat cancer endometrial.,6
PEPI proces, împreună cu rezultatele pe 16,068 femeile aflate la menopauza de la Women ‘ s Health Initiative (WHI), publicat în 2002, și-a vărsat lumină asupra preocupări serioase crescut în anii 1970.7 Deși PEPI studiul a aratat un risc crescut de hiperplazie cu o combinație de produse, CARE a fost găsit crescut în mod semnificativ riscurile asociate cu hormon sintetic utilizat, cum ar fi boli cardiovasculare, accident vascular cerebral, evenimente tromboembolice, și cancerul de sân.,7 a existat un risc crescut de 80% de boli cardiovasculare la 1 an după întreruperea tratamentului combinat ECE/acetat de medroxiprogesteron și un risc crescut de 37% de accident vascular cerebral ischemic în timpul fazei de intervenție cu terapie combinată. De asemenea, riscul de cancer mamar a crescut semnificativ (24%) în timpul intervenției. Utilizarea estrogenului plus-progestin a oferit unele beneficii, pacienții observând o incidență scăzută a atrofiei vaginale, simptome vasomotorii reduse, cum ar fi bufeurile și transpirațiile nocturne și un risc scăzut de cancer colorectal cu 38% în timpul tratamentului cu terapie combinată.,7 Cu toate acestea, datorită importanței riscului crescut de cancer mamar și evenimente tromboembolice, studiul a fost oprit precoce.riscurile discutate mai sus au deschis calea pentru advocacy CHT, deoarece se credea că adaptarea sau personalizarea CHT la pacientul individual ar maximiza beneficiul și ar minimiza riscul. Susține că CHT a fost mai sigur și mai prietenos din punct de vedere biologic a devenit mai proeminent, iar utilizarea sa a crescut., Pinkerton și Santoro au folosit două sondaje diferite-Harris și Rose—pentru a evalua cunoștințele pacienților despre CHT și pentru a cuantifica utilizarea CHT față de terapia hormonală aprobată de FDA.Rezultatele 8 ale sondajului Harris au indicat că 86% dintre femeile cu vârste cuprinse între 40 și 65 de ani nu știau că CHT nu a fost aprobat de FDA, iar rezultatele extrapolate ale sondajului Rose au sugerat că, anual, până la 2,5 milioane de femei mai în vârstă de 40 de ani pot utiliza CHT.8 datele din ambele sondaje au indicat că un medic sau farmacist a recomandat CHT., Aceste rezultate sugerează că există o oportunitate pentru furnizori de a se asigura că pacienții sunt informați despre produsul pe care îl primesc, inclusiv toate riscurile posibile asociate cu terapia hormonală și pentru compoziția farmaciștilor pentru a se asigura că aceștia livrează un produs terapeutic pur în care pacienții pot avea încredere.deoarece FDA nu este responsabil pentru standardizarea produselor compuse, reglementarea cade adesea la Consiliile de stat ale farmaciei., Aceste panouri de obicei nu au resursele necesare pentru a efectua inspecții periodice ale farmaciilor compuse, iar FDA intervine numai atunci când se face o plângere.9 Deși formulările compuse nu sunt obligate din punct de vedere legal să poarte avertismente de risc, teoretic aceste produse pot prezenta aceleași riscuri ca și cele menționate mai sus pentru terapia hormonală sintetică. Până în prezent, cu toate acestea, nu au existat studii de siguranță cap-la-cap de CHT comparativ cu hormoni sintetici.,10
Există trei tipuri de estrogeni o femeie poate primi ca parte a unui agravată de substitutie hormonala regim: estrona (E1), estradiol (E2) și estriol (E3), fiecare având un grad variabil de potenta (E2 > E1 > E3).9 deoarece trăiesc pentru același receptor, acești estrogeni acționează ca inhibitori competitivi, ducând la scăderea eficacității dacă nu sunt corect echilibrați.,11 prin Urmare, sustinatorii CHT dezvoltat Biest (E2 + E3 într-un 20/80 formulare) și Trieste (E1 + E2 + E3 într-un 10/10/80 formulare), în scopul de a maximiza fiziologice potenta, dar în prezent nu există dovezi care să susțină afirmația că aceste formulări în aceste raporturi conferă niciun beneficiu de siguranță comparativ cu hormon sintetic terapie.11
Deși pe ansamblu CHT a fost insuficient studiat și nereglementat, în octombrie 2018, pe baza constatărilor din REFACE proces, Bijuva a devenit primul FDA a aprobat bioidentici combinație de 17-beta estradiol-progesteron formulare., REPLENISH, un studiu multicentric de fază III, randomizat, dublu-orb, controlat cu placebo, a investigat eficacitatea, siguranța endometrială și siguranța generală a patru doze diferite ale unei singure capsule 17-beta estradiol-progesteron pentru simptome vasomotorii moderate până la severe la femeile aflate în postmenopauză.Criteriul final principal de evaluare a siguranței a fost incidența hiperplaziei endometriale la 12 luni. La 12 luni, nu s-au observat cazuri de hiperplazie endometrială pentru niciuna dintre formulările de dozare estradiol-progesteron.,12 La 12 săptămâni, estradiol 1 mg–100 mg progesteron formulare a demonstrat cea mai mare reducere semnificativă statistic a vasomotorii simptom ca frecvență și severitate comparativ cu placebo, în timp ce menținerea primare de siguranță-endpoint standarde.12 Cu toate acestea, așa cum am menționat anterior, nu au existat studii care să compare siguranța hormonilor sintetici față de formulările hormonale bioidentice, deci teoretic riscurile rămân.,pe baza studiului REPLENISH, femeile pre -, peri-și postmenopauză au acum un tratament standardizat, reglementat, bioidentic, aprobat de FDA pentru simptomele vasomotorii. Sunt necesare studii viitoare pentru a delimita complet profilul de siguranță al estradiolului 17-beta și CHT. Farmaciștii ar trebui să recomande orice formulare de hormon oral pentru cea mai scurtă durată fezabilă., În plus, dacă CHT este ales, farmaciștii ar trebui să se asigure că pacienții lor știu ce este CHT și cum diferă de hormonii sintetici, având, de asemenea, o conversație sinceră despre beneficiile și riscurile terapiei de substituție hormonală.
1. Martin KA, Manson JE. Abordarea pacientului cu simptome de menopauză. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, și colab. Durata simptomelor vasomotorii menopauzei peste tranziția menopauzei. JAMA Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, și colab., Hormoni bioidentici compuși în practica endocrinologică: o declarație științifică a Societății Endocrine. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Estrogeni și progestine: fundal și istoric, tendințe în utilizare și orientări și regimuri aprobate de US Food and Drug Administration. Am J Med. 2005; 118 (supl 12B):64-73.
5. Grupul de scriere pentru procesul PEPI. Efectele terapiei de substituție hormonală asupra histologiei endometriale la femeile aflate în postmenopauză. Studiul intervențiilor de Estrogen/Progestin postmenopauză (PEPI). JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. trei cazuri de cancer endometrial asociate cu terapia de substituție hormonală” bioidentical”. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, și colab. Riscurile și beneficiile estrogenului plus progestin la femeile aflate în postmenopauză sănătoase: rezultate principale din studiul randomizat controlat Women ‘ s Health Initiative. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. compus bioidentical hormon terapie: identificarea tendințelor de utilizare și a lacunelor de cunoștințe în rândul femeilor din SUA. Menopauza. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Concepția greșită și preocupările legate de hormonii bioidentici folosiți pentru terapia hormonală combinată personalizată. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiol și progesteron) prospect. Boca Raton, FL: TherapeuticsMD, Inc; noiembrie 2019.
11. Kuhl H. farmacologia estrogenilor și progestogenilor: influența diferitelor căi de administrare. Climacteric. 2005; 8 (supl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, și colab. O capsulă orală 17beta-estradiol-progesteron pentru simptomele vasomotorii la femeile aflate în postmenopauză: un studiu randomizat controlat. Obstet Gynecol., 2018;132(1):161-170.conținutul conținut în acest articol este doar în scop informativ. Conținutul nu este destinat să înlocuiască sfaturile profesionale. Dependența de orice informații furnizate în acest articol este exclusiv pe propriul risc.