obiective de învățare
până la sfârșitul acestei secțiuni, veți putea:
- descrie modul în care au fost descoperiți electronii.
- explicați experimentul cu picături de ulei Millikan.
- descrieți experimentul cu folie de aur al lui Rutherford.
- descrie modelul planetar al atomului lui Rutherford.la fel cum atomii sunt o substructură a materiei, electronii și nucleele sunt substructuri ale atomului., Experimentele care au fost folosite pentru a descoperi electroni și nuclee dezvăluie unele dintre proprietățile de bază ale atomilor și pot fi ușor înțelese folosind idei precum forța electrostatică și magnetică, deja acoperite în capitolele anterioare.în discuțiile anterioare, am observat că sarcina pozitivă este asociată cu nucleele și sarcina negativă cu electronii. Am acoperit, de asemenea, multe aspecte ale forțelor electrice și magnetice care afectează încărcăturile., Vom explora acum descoperirea electronului și a nucleului ca substructuri ale atomului și vom examina contribuțiile lor la proprietățile atomilor.
Electronul

Figura 1. Un tub de descărcare de gaz strălucește atunci când i se aplică o tensiune înaltă. Electronii emiși de catod sunt accelerați spre anod, excită atomii și moleculele din gaz, care strălucesc ca răspuns., Odată numite tuburi Geissler și mai târziu tuburi Crookes, acestea sunt acum cunoscute sub numele de tuburi catodice (CRT) și se găsesc în televizoare mai vechi, ecrane de computer și mașini cu raze X. Când se aplică un câmp magnetic, fasciculul se îndoaie în direcția așteptată pentru încărcare negativă. (credit: Paul Downey, Flickr)
tuburile cu descărcare în gaz, cum ar fi cele prezentate în Figura 1, constau dintr-un tub de sticlă evacuat care conține doi electrozi metalici și un gaz rarefiat. Când se aplică o tensiune înaltă la electrozi, gazul strălucește. Aceste tuburi au fost precursorii luminilor de neon de astăzi., Au fost studiate pentru prima oară în serios de către Heinrich Geissler, un inventator German și sticlar, începând din 1860. Omul de știință englez William Crookes, printre altele, a continuat să studieze ceea ce pentru un timp au fost numite tuburi Crookes, în care electronii sunt eliberați de atomi și molecule în gaz rarefiat în interiorul tubului și sunt accelerate de la catod (negativ) la anod (pozitiv) de potențial ridicat., Aceste „raze catodice” se ciocnesc cu atomii și moleculele de gaz și le excită, rezultând emisia de radiații electromagnetice (EM) care face calea electronilor vizibilă ca o rază care se răspândește și se estompează pe măsură ce se îndepărtează de catod.
tuburile cu descărcare în gaz astăzi sunt cel mai frecvent numite tuburi catodice, deoarece razele provin de la catod. Crookes a arătat că electronii transporta impuls (ei pot face o roată mică paletă roti)., De asemenea, el a descoperit că calea lor normală dreaptă este îndoită de un magnet în direcția așteptată pentru o sarcină negativă care se îndepărtează de catod. Acestea au fost primele indicații directe ale electronilor și ale încărcăturii lor.

Figura 2. J. J. Thomson (credit: www.firstworldwar.com, prin Wikimedia Commons)
fizicianul englez J. J. Thomson (1856-1940) a îmbunătățit și extins domeniul de aplicare de experimente cu tuburi cu descărcare în gaze. (A se vedea Figura 2 și Figura 3.,) El a verificat sarcina negativă a razelor catodice cu câmpuri magnetice și electrice. În plus, el a colectat razele într-o ceașcă de metal și a găsit un exces de sarcină negativă. Thomson a fost, de asemenea, capabil să măsoare raportul dintre sarcina electronului și masa sa, \frac{q_e}{m_e}\\—un pas important pentru găsirea valorilor reale ale qe și me. Figura 4 prezintă un tub catodic, care produce un fascicul îngust de electroni care trece prin plăcile de încărcare conectate la o sursă de alimentare de înaltă tensiune., Un câmp electric E este produs între plăcile de încărcare, iar tubul catodic este plasat între polii unui magnet, astfel încât câmpul electric E să fie perpendicular pe câmpul magnetic B al magnetului. Aceste câmpuri, fiind perpendiculare între ele, produc forțe opuse asupra electronilor. Așa cum s-a discutat pentru spectrometrele de masă în mai multe aplicații ale magnetismului, dacă forța netă datorată câmpurilor dispare, atunci viteza particulei încărcate este v=\frac{E}{B}\\., În acest mod, Thomson a determinat viteza electronilor și apoi a mutat fasciculul în sus și în jos prin reglarea câmpului electric.

Figura 3. Diagrama CRT a lui Thomson. (credit: Kurzon, Wikimedia Commons)

Figura 4. Această schemă arată fasciculul de electroni într-un CRT care trece prin câmpuri electrice și magnetice încrucișate și care provoacă strălucirea fosforului atunci când lovește capătul tubului.
Colectarea termeni, ne-am \frac{q_e}{m_e}=\frac{a}{E}\\.,
Ce este atât de important \frac{q_e}{m_e}\\, raportul dintre electroni se încarcă la masa? Valoarea obținută este
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (electroni)}\\
Acesta este un număr foarte mare, ca Thomson a realizat, și se presupune că electronul are o masă foarte mică. Din galvanizare se știa că este nevoie de aproximativ 108 C/kg pentru a placa un material, un factor de aproximativ 1000 mai mic decât încărcarea pe kilogram de electroni., Thomson a continuat să facă același experiment pentru ionii de hidrogen încărcați pozitiv (acum cunoscuți a fi protoni goi) și a găsit o sarcină pe kilogram de aproximativ 1000 de ori mai mică decât cea pentru electron, ceea ce înseamnă că protonul este de aproximativ 1000 de ori mai masiv decât electronul. Astăzi, știm mai precis că
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
în cazul în care qp este responsabil de protoni și mp este masa acestuia. Acest raport (la patru cifre semnificative) este de 1836 de ori mai puțin încărcare pe kilogram decât pentru electron., Deoarece sarcinile electronilor și protonilor sunt egale în mărime, Aceasta implică mp = 1836me.Thomson a efectuat o varietate de experimente folosind diferite gaze în tuburile de descărcare și folosind alte metode, cum ar fi efectul fotoelectric, pentru eliberarea electronilor de atomi. El a găsit întotdeauna aceleași proprietăți pentru electron, dovedind că este o particulă independentă. Pentru munca sa, piesele importante pe care a început să le publice în 1897, Thomson a primit Premiul Nobel pentru Fizică din 1906., În retrospectivă, este dificil să apreciem cât de uimitor a fost să constatăm că atomul are o substructură. Thomson însuși a spus: „abia când am fost convins că experimentul nu a lăsat nici o scăpare din el, mi-am publicat credința în existența unor corpuri mai mici decât atomii.Thomson a încercat să măsoare sarcina electronilor individuali, dar metoda lui ar putea determina sarcina sa doar la ordinul de mărime așteptat.
de la experimentele lui Faraday cu galvanizare în anii 1830, se știa că aproximativ 100.000 C pe mol era necesar pentru a placa ioni ionizați individual., Împărțind acest lucru la numărul de ioni pe mol (adică la numărul lui Avogadro), care era aproximativ cunoscut, încărcarea pe ion a fost calculată la aproximativ 1, 6 × 10-19 C, aproape de valoarea reală.

Figura 5. Robert Millikan (credit: Autor Necunoscut, prin Wikimedia Commons)
Un fizician American, Robert Millikan (1868-1953) (a se vedea Figura 5), a decis să îmbunătățească Thomson experiment pentru măsurarea qe și a fost în cele din urmă obligat să încerce o altă abordare, care este acum un experiment clasic efectuat de către studenți., Experimentul cu picături de ulei Millikan este prezentat în Figura 6.
în experimentul Millikan oil drop, picături fine de ulei sunt pulverizate dintr-un atomizor. Unele dintre acestea sunt încărcate de proces și pot fi apoi suspendate între plăcile metalice printr-o tensiune între plăci. În această situație, în greutate de scădere este echilibrată de forța electrică:
m dropg = qe E

Figura 6., Experimentul Millikan oil drop a produs prima măsurare directă exactă a încărcăturii pe electroni, una dintre cele mai fundamentale constante din natură. Picăturile Fine de ulei se încarcă atunci când sunt pulverizate. Mișcarea lor este observată între plăcile metalice cu un potențial aplicat pentru a se opune forței gravitaționale. Echilibrul forțelor gravitaționale și electrice permite calcularea încărcăturii pe o picătură. Încărcarea se dovedește a fi cuantificată în unități de -1,6 × 10-19 C, determinând astfel direct încărcarea excesului și electronilor lipsă pe picăturile de ulei.,
câmpul electric este produs de tensiunea aplicată, prin urmare, E=\frac{v}{d}\\, iar V este ajustat pentru a echilibra doar greutatea picăturii. Picăturile pot fi văzute ca puncte de lumină reflectată folosind un microscop, dar sunt prea mici pentru a măsura direct dimensiunea și masa lor. Masa picăturii este determinată observând cât de repede scade atunci când tensiunea este oprită. Deoarece rezistența aerului este foarte semnificativă pentru aceste picături submicroscopice, picăturile mai masive cad mai repede decât cele mai puțin masive, iar calculele sofisticate de sedimentare le pot dezvălui masa., Uleiul este folosit mai degrabă decât apa, deoarece nu se evaporă ușor și astfel masa este aproape constantă. După masa de drop este cunoscut, taxa de electron este dat de rearanjând ecuația anterioară:
\displaystyle{q}=\frac{m_{\text{picătură}}g}{E}=\frac{m_{\text{picătură}}gd}{V}\\,
în cazul în care d este separarea de plăci și V este tensiunea care deține picătură nemișcat. (Aceeași picătură poate fi observată timp de câteva ore pentru a vedea că este într-adevăr nemișcată.,) Prin 1913 Millikan a măsurat taxa de electroni qe cu o precizie de 1%, și a îmbunătățit acest lucru cu un factor de 10, în câțiva ani, la o valoare de -1.60 × 10-19 C. de asemenea, El a observat că toate acuzațiile au fost multipli de bază de electroni încărcați și că schimbările bruște ar putea avea loc in care electronii au fost adăugate sau eliminate din picături. Pentru această măsurare directă fundamentală a qe și pentru studiile sale asupra efectului fotoelectric, Millikan a primit Premiul Nobel pentru Fizică din 1923.,cu sarcina electronului cunoscut și raportul încărcare-masă cunoscut, masa electronului poate fi calculată. Este
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
Înlocuind valorile cunoscute producții
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
sau m = 9.11 × 10-31 kg (electron de masă), în cazul în care rotunji erori au fost corectate., Masa electronului a fost verificată în multe experimente ulterioare și este acum cunoscută cu o precizie mai bună decât o parte dintr-un milion. Este o masă incredibil de mică și rămâne cea mai mică masă cunoscută a oricărei particule care are masă. (Unele particule, cum ar fi fotonii, sunt fără masă și nu pot fi aduse la odihnă, ci călătoresc cu viteza luminii.) Un calcul similar dă masele altor particule, inclusiv protonul. La trei cifre, masa protonului este acum cunoscută a fi mp = 1.67 × 10-27 kg (masa protonului), care este aproape identică cu masa unui atom de hidrogen., Ceea ce Thomson și Millikan au făcut a fost să demonstreze existența unei substructuri de atomi, electronul, și mai departe să arate că avea doar o mică fracțiune din masa unui atom. Nucleul unui atom conține cea mai mare parte a masei sale, iar natura nucleului a fost complet neanticipată.o altă caracteristică importantă a mecanicii cuantice a început, de asemenea, să apară. Toți electronii sunt identici unul cu celălalt. Sarcina și masa electronilor nu sunt valori medii; mai degrabă, ele sunt valori unice pe care le au toți electronii., Acest lucru este valabil și pentru alte entități fundamentale la nivel submicroscopic. Toți protonii sunt identici unul cu celălalt și așa mai departe.
nucleul
aici, examinăm primele dovezi directe ale mărimii și masei nucleului. În capitolele ulterioare, vom examina multe alte aspecte ale fizicii nucleare, dar informațiile de bază privind dimensiunea și masa nucleară sunt atât de importante pentru înțelegerea atomului pe care îl considerăm aici.radioactivitatea nucleară a fost descoperită în 1896 și a fost în curând subiectul unui studiu intens de către un număr de cei mai buni oameni de știință din lume., Printre ei a fost noul Zealander Lord Ernest Rutherford, care a făcut numeroase descoperiri fundamentale și a câștigat titlul de „tată al fizicii nucleare.”Născut în Nelson, Rutherford și-a făcut studiile postuniversitare la laboratoarele Cavendish din Anglia înainte de a ocupa o poziție la Universitatea McGill din Canada, unde a făcut munca care i-a adus Premiul Nobel pentru Chimie în 1908. În domeniul fizicii atomice și nucleare, există multe suprapuneri între chimie și fizică, fizica oferind teoriile fundamentale care permit., S-a întors în Anglia în anii următori și a avut șase viitori câștigători ai Premiului Nobel ca studenți. Rutherford a folosit radiații nucleare pentru a examina direct dimensiunea și masa nucleului atomic. Experimentul pe care la conceput este prezentat în Figura 7. O sursă radioactivă care emite radiații alfa a fost plasată într-un recipient de plumb cu o gaură într-o parte pentru a produce un fascicul de particule alfa, care sunt un tip de radiație ionizantă ejectată de nucleele unei surse radioactive., O folie subțire de aur a fost plasată în fascicul, iar împrăștierea particulelor alfa a fost observată de strălucirea pe care au provocat-o când au lovit un ecran de fosfor.

Figura 5. Experimentul lui Rutherford a dat dovezi directe pentru dimensiunea și masa nucleului prin împrăștierea particulelor alfa dintr-o folie subțire de aur. Alfa particule cu energii de aproximativ 5MeV sunt emise de o sursă radioactivă (care este un mic recipient de metal în care o anumită cantitate de material radioactiv este sigilat), sunt într-un fascicul colimat, și cădea pe folie., Numărul de particule care pătrund în folie sau se împrăștie în diferite unghiuri indică faptul că nucleele de aur sunt foarte mici și conțin aproape toată masa atomului de aur. Acest lucru este indicat în special de particulele alfa care se împrăștie în unghiuri foarte mari, la fel ca o minge de fotbal care cade de pe capul unui portar.,particulele alfa erau cunoscute a fi nucleele pozitive încărcate dublu ale atomilor de heliu care aveau energii cinetice de ordinul a 5 MeV atunci când sunt emise în dezintegrarea nucleară, care este dezintegrarea nucleului unui nuclid instabil prin emisia spontană de particule încărcate. Aceste particule interacționează cu materia mai ales prin forța Coulomb, iar modul în care se împrăștie din nuclee poate dezvălui dimensiunea și masa nucleară. Acest lucru este analog cu observarea modului în care o minge de bowling este împrăștiată de un obiect pe care nu îl puteți vedea direct., Deoarece energia particulei alfa este atât de mare în comparație cu energiile tipice asociate cu atomii (MeV versus eV), v-ați aștepta ca particulele alfa să se prăbușească pur și simplu printr-o folie subțire, la fel cum o minge de bowling supersonică s-ar prăbuși prin câteva zeci de rânduri de pini de bowling. Thomson a imaginat că atomul este o sferă mică în care cantități egale de sarcină pozitivă și negativă erau distribuite uniform. Particulele alfa masive incidente ar suferi doar mici devieri într-un astfel de model., În schimb, Rutherford și colaboratorii săi au descoperit că particulele alfa erau ocazional împrăștiate în unghiuri mari, unele chiar înapoi în direcția din care veneau! Analiza detaliată folosind conservarea impulsului și a energiei—în special a numărului mic care a revenit direct-a sugerat că nucleele de aur sunt foarte mici în comparație cu dimensiunea unui atom de aur, conțin aproape toată masa atomului și sunt strâns legate. Deoarece nucleul de aur este de câteva ori mai masiv decât particula alfa, o coliziune frontală ar împrăștia particula alfa direct înapoi spre sursă., În plus, cu cât nucleul este mai mic, cu atât mai puține particule alfa ar lovi un cap.deși rezultatele experimentului au fost publicate de colegii săi în 1909, Rutherford a avut nevoie de doi ani pentru a se convinge de semnificația lor. Ca și Thomson înaintea lui, Rutherford a fost reticent în a accepta astfel de rezultate radicale. Natura la scară mică este atât de diferită de lumea noastră clasică, încât chiar și cei aflați în fruntea descoperirii sunt uneori surprinși. Rutherford a scris mai târziu: „a fost aproape la fel de incredibil ca și cum ai tras o cochilie de 15 inch într-o bucată de hârtie absorbantă și s-a întors și te-a lovit., Pe considerație, am dat seama că această împrăștiere înapoi . . . . . . cea mai mare parte a masei atomului a fost concentrată într-un nucleu mic.în 1911, Rutherford și-a publicat analiza împreună cu un model propus al atomului. Dimensiunea nucleului a fost determinată a fi de aproximativ 10-15 m sau de 100.000 de ori mai mică decât atomul. Aceasta implică o densitate uriașă, de ordinul a 1015 g/cm3, cu mult spre deosebire de orice materie macroscopică. De asemenea, este implicată existența unor forțe nucleare necunoscute anterior pentru a contracara uriașele forțe Coulomb respingătoare printre încărcăturile pozitive din nucleu., Forțele uriașe ar fi, de asemenea, în concordanță cu energiile mari emise în radiațiile nucleare.

Figura 8. O vedere extinsă a atomilor din folia de aur din experimentul lui Rutherford. Cercurile reprezintă atomii (aproximativ 10-10 m în diametru), în timp ce punctele reprezintă nucleele (aproximativ 10-15 m în diametru). Pentru a fi vizibile, punctele sunt mult mai mari decât scara. Majoritatea particulelor alfa se prăbușesc, dar sunt relativ neafectate din cauza energiei lor mari și a masei mici a electronului., Unii, cu toate acestea, capul drept spre un nucleu și sunt împrăștiate drept înapoi. O analiză detaliată dă dimensiunea și masa nucleului.dimensiunea mică a nucleului implică, de asemenea, că atomul este în mare parte gol în interior. De fapt, în experimentul lui Rutherford, majoritatea alfa au trecut direct prin folia de aur cu foarte puțină împrăștiere, deoarece electronii au mase atât de mici și deoarece atomul era în mare parte gol, fără nimic pentru ca Alfa să lovească., Au existat deja indicii despre acest lucru în momentul în care Rutherford și-a efectuat experimentele, deoarece s-a observat că electronii energetici pătrund în folii subțiri mai ușor decât se aștepta. Figura 8 prezintă o schemă a atomilor într-o folie subțire cu cercuri reprezentând dimensiunea atomilor (aproximativ 10-10 m) și puncte reprezentând nucleele. (Punctele nu sunt la scară—dacă ar fi, ai avea nevoie de un microscop pentru a le vedea. Majoritatea particulelor alfa ratează nucleele mici și sunt doar ușor împrăștiate de electroni., Ocazional, (aproximativ o dată în 8000 ori în experimentul lui Rutherford), un alfa lovește un nucleu cap-on și este împrăștiat drept înapoi.

Figura 9. Modelul planetar al atomului lui Rutherford încorporează caracteristicile nucleului, electronilor și mărimea atomului. Acest model a fost primul care a recunoscut structura atomilor, în care electronii cu masă mică orbitează un nucleu foarte mic, masiv, în orbite mult mai mari decât nucleul. Atomul este în mare parte gol și este analog cu sistemul nostru planetar.,pe baza mărimii și masei nucleului dezvăluit de experimentul său, precum și a masei electronilor, Rutherford a propus modelul planetar al atomului. Modelul planetar al atomului prezintă electroni de masă joasă care orbitează un nucleu de masă mare. Dimensiunile orbitelor electronice sunt mari în comparație cu dimensiunea nucleului, cu cea mai mare parte vid în interiorul atomului. Această imagine este analogă cu modul în care planetele cu masă mică din sistemul nostru solar orbitează Soarele cu masă mare la distanțe mari în comparație cu dimensiunea Soarelui., În atom, forța atractivă Coulomb este analogă gravitației din sistemul planetar. (A Se Vedea Figura 9.) Rețineți că este necesar un model sau o imagine mentală pentru a explica rezultatele experimentale, deoarece atomul este prea mic pentru a fi observat direct cu lumina vizibilă.modelul planetar al atomului lui Rutherford a fost crucial pentru înțelegerea caracteristicilor atomilor și a interacțiunilor și energiilor lor, așa cum vom vedea în următoarele secțiuni. De asemenea, a fost o indicație a naturii diferite de lumea clasică familiară pe scara mecanică cuantică mică., Descoperirea unei substructuri pentru toată materia sub formă de atomi și molecule a fost făcută acum cu un pas mai departe pentru a dezvălui o substructură de atomi care era mai simplă decât cele 92 de elemente cunoscute atunci. Am continuat să căutăm substructuri mai profunde, cum ar fi cele din interiorul nucleului, cu un anumit succes. În capitolele ulterioare, vom urmări această căutare în discuția despre cuarci și alte particule elementare și ne vom uita la direcția în care căutarea pare să se îndrepte acum.,
PhET Explorations: împrăștierea Rutherford
cum și-a dat seama Rutherford structura atomului fără să-l poată vedea? Simulați celebrul experiment în care a respins modelul de budincă de prune al atomului observând particule alfa care se aruncă de pe atomi și determinând că trebuie să aibă un miez mic.
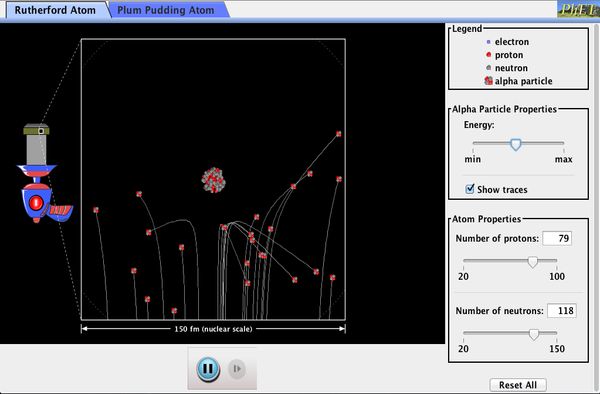
Faceți clic pentru a descărca simularea. Rulați folosind Java.,
Rezumatul secțiunii
probleme& exerciții
- Rutherford a găsit dimensiunea nucleului de aproximativ 10-15 m. aceasta a implicat o densitate uriașă. Care ar fi această densitate pentru aur?
- în experimentul cu picături de ulei al lui Millikan, se uită la o picătură mică de ulei ținută nemișcată între două plăci. Luați tensiunea dintre plăci să fie de 2033 V, iar separarea plăcii să fie de 2,00 cm. Căderea de ulei (cu o densitate de 0,81 g/cm3) are un diametru de 4,0 × 10-6 m. Găsiți sarcina pe picătură, în termeni de unități de electroni.,
- (a) un fizician aspirant vrea să construiască un model la scară largă a unui atom de hidrogen pentru proiectul ei science fair. Dacă atomul are diametrul de 1,00 m, cât de mare ar trebui să încerce să facă nucleul? b) cât de ușor va fi acest lucru?