răspuns lung. În primul rând, trebuie făcută o distincție între polaritatea unei legături și polaritatea unei molecule (sau a unui compus). polaritatea legăturii se referă la o separare a sarcinii electrice care rezultă dintr-o diferență de electronegativitate între cei doi atomi sau grupuri care se leagă împreună.,această diferență în valorile electronegativității dintre cei doi atomi face ca electronii legăturii să fie împărțiți inegal, creând astfel o sarcină postivă (#delta^+#) pe atomul mai puțin electronegativ și o sarcină parțială negativă (#delta^(-)#) pe atomul mai electronegativ. Polaritatea unei legături poate fi determinată folosind numai valorile electronegativității celor doi atomi constituenți. dacă legătura dintre cei doi atomi nu este polară, adică diferența de electronegativitate dintre cei doi atomi este mai mică de 0.,5, atunci molecula ta va fi nepolară. Dacă legătura este într-adevăr polară, puteți continua să încercați să determinați polaritatea moleculei.geometria unei molecule este un factor important în determinarea polarității unei molecule. Aceste taxe parțiale menționate mai sus dau naștere unui moment dipol bond, # mu#. dacă orientările acestor momente de dipol de legătură se anulează reciproc, atunci se spune că molecula este nepolară. Dacă totuși nu, aveți de-a face cu o moleculă polară.,câteva exemple în care momentele dipolului bond se anulează reciproc, rezultând o moleculă nepolară:
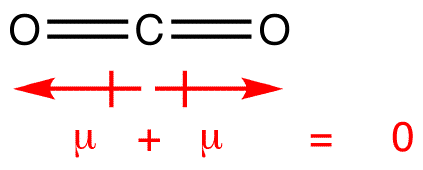
momentele dipolului sunt desenate cu săgeata îndreptată spre atomul mai electronegativ și partea plus pe atomul mai puțin electronegativ. Observați că pentru # CO_2#, care are două legături polare, momentul total al dipolului este zero, deoarece aceste două săgeți se anulează reciproc. Aceasta are ca rezultat o moleculă nepolară., Același lucru poate fi spus pentru #BF_3#:
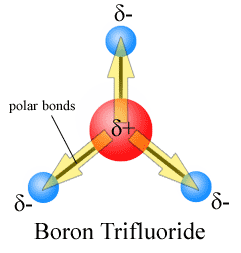
Cele trei momente de dipol se anulează reciproc, ca urmare a aranjament simetric de obligațiuni (a se vedea mai pe vectorul plus).
Un aranjament asimetric de taxe parțiale rezultate într-o moleculă polară, după cum puteți vedea pentru apă:
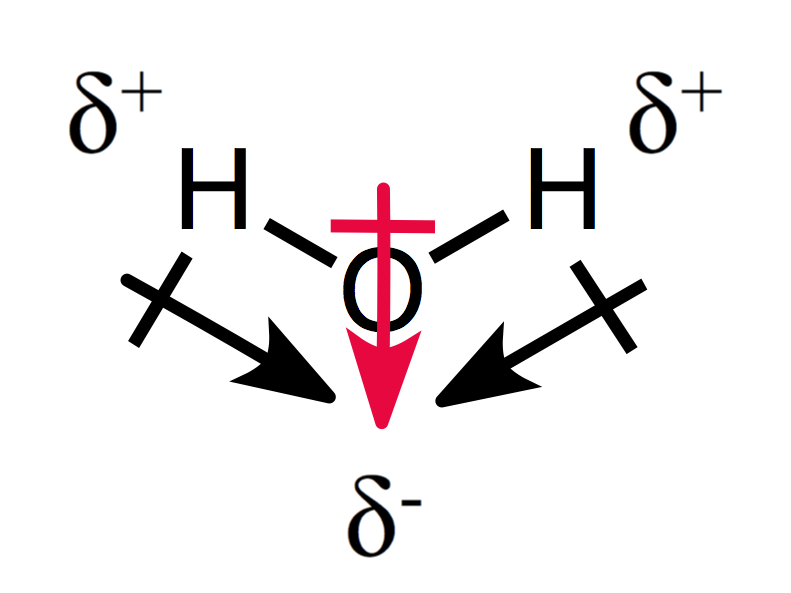
Cele două momente de dipol adăuga pentru fiecare alte creând un ansamblu moment de dipol, și, astfel, o moleculă polară., ca o concluzie ,pentru a prezice polaritatea unei molecule, trebuie să fiți familiarizați cu structurile Lewis, electronegativitatea, teoria VSEPR și polaritatea legăturii.