proteine membranare
în timp ce lipidele sunt elementele structurale fundamentale ale membranelor, proteinele sunt responsabile pentru îndeplinirea funcțiilor specifice ale membranei. Majoritatea membranelor plasmatice constau din aproximativ 50% lipide și 50% proteine în greutate, porțiunile de carbohidrați ale glicolipidelor și glicoproteinelor reprezentând 5 până la 10% din masa membranei. Deoarece proteinele sunt mult mai mari decât lipidele, acest procent corespunde la aproximativ o moleculă de proteină la fiecare 50 până la 100 de molecule de lipide., În 1972, Jonathan Singer și Garth Nicolson au propus modelul mozaic fluid al structurii membranei, care este acum în general acceptat ca paradigmă de bază pentru organizarea tuturor membranelor biologice. În acest model, membranele sunt privite ca fluide bidimensionale în care proteinele sunt inserate în bistraturile lipidice (figura 12.3).

figura 12.3
modelul mozaic Fluid al membranei plasmatice., Proteinele membranare integrale sunt inserate în bistratul lipidic, în timp ce proteinele periferice sunt legate indirect de membrană prin interacțiuni proteină-proteină. Majoritatea proteinelor membranare integrale sunt transmembranare (mai mult…Singer și Nicolson au distins două clase de proteine asociate membranei, pe care le-au numit proteine membranare Periferice și integrale., Proteinele membranare periferice au fost definite operațional ca proteine care se disociază de membrană în urma tratamentelor cu reactivi polari, cum ar fi soluții cu pH extrem sau concentrație mare de sare, care nu perturbă bistratul fosfolipidic. Odată disociate de membrană, proteinele membranei periferice sunt solubile în tampoane apoase. Aceste proteine nu sunt introduse în interiorul hidrofob al bistratului lipidic. În schimb, ele sunt asociate indirect cu membranele prin interacțiuni proteină-proteină., Aceste interacțiuni implică frecvent legături ionice, care sunt perturbate de pH extrem sau de sare ridicată.spre deosebire de proteinele membranei periferice, proteinele membranare integrale pot fi eliberate numai prin tratamente care perturbă bistratul fosfolipidic. Porțiuni ale acestor proteine membranare integrale sunt inserate în bistratul lipidic, astfel încât acestea pot fi disociate numai de reactivi care perturbă interacțiunile hidrofobe., Reactivii cei mai frecvent utilizați pentru solubilizarea proteinelor membranare integrale sunt detergenții, care sunt molecule amfipatice mici care conțin atât grupuri hidrofobe, cât și hidrofile (figura 12.4). Porțiunile hidrofobe ale detergenților înlocuiesc lipidele membranare și se leagă de porțiunile hidrofobe ale proteinelor membranare integrale. Deoarece celălalt capăt al moleculei de detergent este hidrofil, complexele detergent-proteine sunt solubile în soluții apoase.

figura 12.4
solubilizarea proteinelor membranare integrale prin detergenți., Detergenții (de exemplu, octil glucozid) sunt molecule amfipatice care conțin grupe de cap hidrofile și cozi hidrofobe. Cozile hidrofobe se leagă de regiunile hidrofobe ale membranei integrale (mai mult…multe proteine integrale sunt proteine transmembranare, care acoperă bistratul lipidic cu porțiuni expuse pe ambele părți ale membranei. Aceste proteine pot fi vizualizate în micrografele electronice ale membranelor plasmatice preparate prin tehnica fracturii prin îngheț (vezi figura 1.35). În aceste specimene, membrana este împărțită și separată în cele două pliante., Proteinele transmembranare sunt apoi aparente ca particule pe fețele interne ale membranei (figura 12.5).

Figura 12.5
Freeze-fractura de electroni micrografie a omului de celule roșii din sânge membrane. Particulele din membrană sunt proteine transmembranare. (Harold H. Edwards / Visuals Unlimited., porțiunile care acoperă membrana proteinelor transmembranare sunt de obicei helice α de 20 până la 25 de aminoacizi hidrofobi care se introduc în membrana reticulului endoplasmatic în timpul sintezei lanțului polipeptidic (vezi figurile 9.11, 9.12 și 9.13). Aceste proteine sunt apoi transportate în veziculele membranei de la reticulul endoplasmatic la aparatul Golgi și de acolo la membrana plasmatică., Grupurile de carbohidrați sunt adăugate la lanțurile polipeptidice atât în aparatul reticulului endoplasmatic, cât și în aparatul Golgi, astfel încât majoritatea proteinelor transmembranare ale membranei plasmatice sunt glicoproteine cu oligozaharidele lor expuse pe suprafața celulei.studiile asupra globulelor roșii au oferit exemple bune de proteine periferice și integrale asociate cu membrana plasmatică. Membranele eritrocitelor umane conțin aproximativ o duzină de proteine majore, care au fost identificate inițial prin electroforeza în gel a preparatelor membranare., Cele mai multe dintre acestea sunt proteine membranare periferice care au fost identificate ca componente ale citoscheletului cortical, care stau la baza membranei plasmatice și determină forma celulei (vezi capitolul 11). De exemplu, cea mai abundentă proteină membrană periferică a celulelor roșii din sânge este spectrina, care este proteina citoscheletică majoră a eritrocitelor. Alte proteine membranare periferice ale globulelor roșii includ actina, ankyrina și banda 4.1., Ankirina servește ca legătură principală între membrana plasmatică și citoschelet prin legarea atât de spectrină, cât și de banda proteică integrală a membranei 3 (vezi figura 11.11). O legătură suplimentară între membrană și a citoscheletului este oferit de trupa 4.1, care se leagă la intersecții de spectrină și actina, precum și pentru a glycophorin (altă mare parte integrantă proteină a membranei eritrocitelor).cele două proteine membranare integrale majore ale globulelor roșii din sânge, glicoforina și banda 3, oferă exemple bine studiate de structură proteică transmembranară (figura 12.6)., Glicoforina este o glicoproteină mică de 131 aminoacizi, cu o greutate moleculară de aproximativ 30.000, jumătate din care este proteină și jumătate carbohidrat. Glicoforina traversează membrana cu o singură Helix α care acoperă membrana de 23 de aminoacizi, cu porțiunea amino-terminală glicozilată expusă pe suprafața celulei. Deși glicoforina a fost una dintre primele proteine transmembranare care a fost caracterizată, funcția sa precisă rămâne necunoscută. În schimb, funcția celeilalte proteine transmembranare majore a globulelor roșii este bine înțeleasă., Această proteină, cunoscută inițial sub numele de banda 3, este transportorul de anioni responsabil pentru trecerea ionilor de bicarbonat (HCO3-) și clorură (Cl-) pe membrana celulelor roșii din sânge. Lanțul polipeptidic band 3 este 929 aminoacizi și se crede că are 14 regiuni α-elicoidale care acoperă membrana. În interiorul membranei, dimerii din banda 3 formează structuri globulare care conțin canale interne prin care ionii sunt capabili să călătorească peste bistratul lipidic.
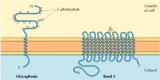
figura 12.6
proteine membranare integrale ale globulelor roșii din sânge., Glicoforina (131 aminoacizi) conține o singură Helix α transmembranar. Este puternic gliocozilat, cu oligozaharide atașate la 16 site-uri de pe porțiunea extracelulară a lanțului polipeptidic. (mai mult…datorită caracterului lor amfipatic, proteinele transmembranare s-au dovedit dificil de cristalizat, așa cum este necesar pentru analiza structurală tridimensională prin difracție cu raze X., Prima proteină transmembranară care a fost analizată prin cristalografia cu raze X a fost centrul de reacție fotosintetică al bacteriei Rhodopseudomonas viridis, a cărei structură a fost raportată în 1985 (figura 12.7). Centrul de reacție conține trei proteine transmembranare, desemnate L, M și H (ușoare, medii și grele) în funcție de dimensiunile aparente indicate prin electroforeză în gel. Subunitățile L și M au fiecare câte cinci helici α cu membrană. Subunitatea H are doar o singură Helix α transmembranar, cu cea mai mare parte a lanțului polipeptidic pe partea citosolică a membranei., A patra subunitate a Centrului de reacție este un citocrom, care este o proteină membrană periferică legată de complex prin interacțiuni proteină-proteină.

figura 12.7
un centru de reacție fotosintetică bacteriană. Centrul de reacție constă din trei proteine transmembranare, desemnate L (Roșu), M (galben) și H (verde). Subunitățile L și M au fiecare cinci helici α transmembranare, în timp ce subunitatea H are doar (mai mult…deși majoritatea proteinelor transmembranare acoperă membrana prin regiuni α-elicoidale, acest lucru nu este întotdeauna cazul., O excepție bine caracterizată este asigurată de porine-o clasă de proteine care formează canale în membranele exterioare ale unor bacterii. Multe bacterii, inclusiv E. coli, au un sistem cu membrană dublă în care membrana plasmatică (sau membrana interioară) este înconjurată de peretele celular și de o membrană exterioară distinctă (figura 12.8). Spre deosebire de membrana plasmatică, membrana exterioară este foarte permeabilă la ioni și molecule polare mici (în cazul E. coli, cu greutăți moleculare de până la 600). Această permeabilitate rezultă din porinele, care formează canale apoase deschise prin bistratul lipidic., După cum sa discutat în Capitolul 10, proteinele legate de porinele bacteriene se găsesc și în membranele exterioare ale mitocondriilor și cloroplastelor.
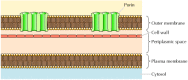
figura 12.8
membrane externe bacteriene. Membrana plasmatică a unor bacterii este înconjurată de un perete celular și o membrană exterioară distinctă. Membrana exterioară conține porine, care formează canale apoase deschise care permit trecerea liberă a ionilor și a moleculelor mici. analiza structurală a indicat că porinele nu conțin regiuni α-elicoidale hidrofobe., În schimb, ele traversează membrana sub formă de butoaie β, în care 16 foi β se pliază într-o structură asemănătoare unui butoi care închide un por apos (figura 12.9). Lanțurile laterale ale aminoacizilor polari aliniază porii, în timp ce lanțurile laterale ale aminoacizilor hidrofobi interacționează cu interiorul membranei. Monomerii porin se asociază pentru a forma trimeri stabili, fiecare conținând trei canale deschise prin care moleculele polare pot difuza pe membrană.

Figura 12.9
Structura unui porin monomer., Fiecare monomer este un butoi β format din 16 fire β antiparalelice (săgeți). Capătul superior al moleculei se confruntă cu mediul extern. (Din H. Nikaido, 1994. J. Biol. Chem. 269: 3905. spre deosebire de proteinele transmembranare, o varietate de proteine (dintre care multe se comportă ca proteine membranare integrale) sunt ancorate în membrana plasmatică de lipide sau glicolipide atașate covalent (figura 12.10). Membrii unei clase a acestor proteine sunt introduși în prospectul exterior al membranei plasmatice prin ancore de glicozilfosfatidilinozitol (GPI)., Ancorele GPI sunt adăugate anumitor proteine care au fost transferate în reticulul endoplasmatic și sunt ancorate în membrană printr-o regiune transmembranară terminală C (vezi figura 9.16). Regiunea transmembranară este scindată pe măsură ce se adaugă ancora GPI, astfel încât aceste proteine rămân atașate la membrană numai de glicolipid. Deoarece lanțurile polipeptidice ale proteinelor ancorate în GPI sunt transferate în reticulul endoplasmatic, acestea sunt glicozilate și expuse pe suprafața celulei după transportul către membrana plasmatică.
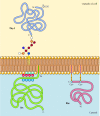
Figura 12.,10
Exemple de proteine ancorate în membrana plasmatică de lipide și glicolipide. Unele proteine (de exemplu, proteina limfocitară Thy-1) sunt ancorate în prospectul exterior al membranei plasmatice prin ancore GPI adăugate la terminalul lor C din reticulul endoplasmatic. (mai mult…alte proteine sunt ancorate în prospectul interior al membranei plasmatice prin lipide atașate covalent. În loc să fie prelucrate prin calea secretorie, aceste proteine sunt sintetizate pe ribozomi citosolici liberi și apoi modificate prin adăugarea de lipide., Aceste modificări includ adăugarea de acid miristic (a 14-carbon, acizi grași) pentru a amino-terminal al lanțului polipeptidic, adaos de acid palmitic (16 atomi de carbon) la partea lanțuri de reziduuri de cisteină, și adăugarea de prenyl grupuri (15 sau 20 de atomi de carbon) la partea lanțuri de carboxi-terminal reziduuri de cisteină (a se vedea Figurile 7.29, 7.30, și 7,31). În unele cazuri, aceste proteine (dintre care multe se comportă ca proteine membranare periferice) sunt direcționate către membrana plasmatică de regiunile încărcate pozitiv ale lanțului polipeptidic, precum și de lipidele atașate., Aceste domenii de proteine încărcate pozitiv pot interacționa cu grupările capului încărcate negativ ale fosfatidilserinei pe fața citosolică a membranei plasmatice. Este de remarcat faptul că multe dintre proteinele ancorate în prospectul interior al membranei plasmatice (inclusiv proteinele Src și Ras ilustrate în figura 12.10) joacă un rol important în transmiterea semnalelor de la receptorii de pe suprafața celulei la ținte intracelulare, așa cum s-a discutat în capitolul următor.