O titrare este o tehnică volumetrică în care o soluție de un reactant (titrantului) este adăugat la o soluție de un al doilea reactant (a „analit”) până la punctul de echivalență este de ajuns. Punctul de echivalență este punctul în care titrantul a fost adăugat exact în cantitatea potrivită pentru a reacționa stoichiometric cu analitul (când molii titrantului = molii analitului). Dacă titrantul sau analitul este colorat, punctul de echivalență este evident din dispariția culorii pe măsură ce reactanții sunt consumați., În caz contrar, se poate adăuga un indicator care are un „punct final” (își schimbă culoarea) la punctul de echivalență sau punctul de echivalență poate fi determinat pe baza unei curbe de titrare. Cantitatea de titrant adăugat este determinată din concentrația și volumul său:
n (mol) = C (mol/L) * V (L)
și cantitatea de titrant poate fi utilizată în calculul stoichiometric obișnuit pentru a determina cantitatea de analit.procesul de titrare poate fi observat în videoclipul de mai jos.,
un volum măsurat al soluției care trebuie titrat, în acest caz, acidul acetic apos incolor, CH3COOH(aq) este plasat într-un pahar. Hidroxidul de sodiu incolor NaOH (aq), care este titrantul, se adaugă cu atenție cu ajutorul unui biuret. Volumul titrantului adăugat poate fi apoi determinat prin citirea nivelului de lichid din biuret înainte și după titrare. Această citire poate fi de obicei estimată la cea mai apropiată sutime de mililitru, astfel încât adăugările precise ale titrantului pot fi făcute rapid.,
Ca primul câțiva mililitri de soluție de titrare curge în vas, un indicator pe scurt modificări de culoare roz, dar revine la incolor rapid. Acest lucru se datorează unui exces mare de acid acetic. Reactivul limitator NaOH este consumat în întregime.
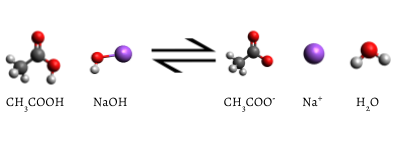
indicatorul adăugat se schimbă în roz când titrarea este completă, indicând faptul că tot acidul acetic apos a fost consumat de NaOH(aq). Reacția care apare este
\
În cele din urmă, tot acidul acetic este consumat., Adăugarea chiar și a unei fracțiuni dintr-o picătură de titrant produce o culoare roz de durată datorită NaOH nereacționat în balon. Schimbarea culorii care apare la punctul final al indicatorului indică faptul că tot acidul acetic a fost consumat, astfel încât am ajuns la punctul de echivalență al titrării. Dacă s-ar adăuga puțin mai multă soluție de NaOH, ar exista un exces și culoarea soluției din balon ar deveni mult mai întunecată. Punctul final apare brusc și trebuie să aveți grijă să nu depășiți punctul final.după ce titrarea a atins punctul final, se citește un volum final din biuretă., Utilizarea inițială și finală lectură, volumul adăugate pot fi determinate destul de precis:
obiectul de titrare este întotdeauna de a adăuga doar cantitatea de titrant necesar pentru a consuma exact cantitatea de substanță a fi ajustată. În reacția NaOH—CH3COOH Eq. \(\ref{2}\), punctul de echivalență apare atunci când o cantitate molară egală de NaOH a fost adăugată din cilindrul gradat pentru fiecare mol de CH3COOH inițial în Balonul de titrare., Adică, la punctul de echivalență, raportul dintre cantitatea de NaOH adăugată la cantitatea de CH3COOH consumată trebuie să fie egal cu raportul stoichiometric
\
titrarea este adesea folosită pentru a determina concentrația unei soluții. În multe cazuri, nu este o chestiune simplă să se obțină o substanță pură, să se cântărească cu precizie și să se dizolve într-un balon volumetric, așa cum s-a făcut în exemplul 1 al concentrațiilor soluției. NaOH, de exemplu, se combină rapid cu H2O și CO2 din aer și astfel chiar și o probă proaspăt preparată de NaOH solid nu va fi pură., Greutatea sa s-ar schimba continuu pe măsură ce CO2(g) și H2O(g) au fost absorbite. Clorura de hidrogen (HCl) este un gaz la temperaturi și presiuni obișnuite, ceea ce face foarte dificil de manevrat sau cântărit. Soluțiile apoase ale ambelor substanțe trebuie standardizate, adică concentrațiile lor trebuie determinate prin titrare.de departe, cea mai frecventă utilizare a titrărilor este determinarea necunoscutelor, adică determinarea concentrației sau cantității de substanță dintr-o probă despre care inițial nu știam nimic. Următorul exemplu implică un necunoscut pe care multe persoane îl întâlnesc în fiecare zi.,
308.0 mg obținut în acest exemplu este în acord rezonabil cu cererea producătorului de 300 mg. Tabletele sunt ștanțate de mașini, nu cântărite individual, astfel încât este de așteptat o anumită variație.