cele nauki
- poznaj teorię orbitali molekularnych.
- Naucz się obliczać zlecenia obligacji.
- Naucz się rysować Schematy energii orbitali molekularnych konfiguracji elektronowej.
teoria wiązania Valence ' a jest w stanie wyjaśnić wiele aspektów wiązania, ale nie wszystkie. Aby uzupełnić tę teorię, używamy innej, zwanej teorią orbitali molekularnych (MO)., Teoria orbitali molekularnych jest bardziej wyrafinowanym modelem do zrozumienia natury wiązania chemicznego.
teoria mo przenosi ideę nakładania się orbitali atomowych na nowy poziom, gdzie nowe orbitale molekularne są generowane za pomocą matematycznego procesu zwanego kombinacją liniową orbitali atomowych (lcao).
orbitale molekularne mają wiele podobieństw do orbitali atomowych:
– są wypełnione od najniższej energii do najwyższej energii (zasada Aufbaua).
– mogą posiadać maksymalnie dwa elektrony o przeciwnym spinie na orbital(zasada wykluczenia Pauli).,
główną różnicą między orbitalami atomowymi i molekularnymi jest to, że orbitale atomowe reprezentują gęstość elektronów w przestrzeni związanej z konkretnym atomem. Orbitale molekularne są związane z całą cząsteczką, co oznacza, że gęstość elektronów jest delokalizowana (rozłożona) na więcej niż jeden atom.
orbitale molekularne cząsteczki wodoru
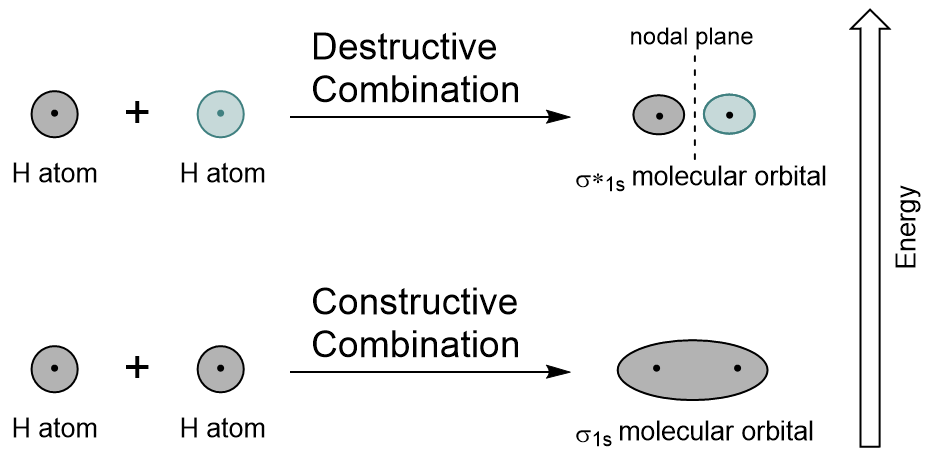
łącząc orbitale 1s każdego atomu wodoru za pomocą LCAO, dwa orbitale molekularne są generowane σ1s (wymawiane sigma one S) i σ*1s (wymawiane sigma star one S).,
Orbital σ1s jest generowany przez kombinację konstrukcyjną( lub interferencję), w której dwie funkcje falowe orbitali atomowych wzmacniają się (dodają) do siebie. Jest to niższa energia dwóch orbitali molekularnych i jest znana jako Wiązanie orbitali molekularnych. Zauważ na rysunku 9.19 „Hydrogen molecular orbital combination diagram”, że gęstość elektronowa tego orbitalu jest skoncentrowana między dwoma jądrami. Elektrony te są stabilizowane przez przyciąganie do obu jąder i trzymają Atomy razem z wiązaniem kowalencyjnym.,
Orbital σ*1s jest generowany przez destrukcyjną kombinację (lub interferencję), w której funkcje falowe dwóch orbitali atomowych wzajemnie się znoszą. Ten rodzaj kombinacji powoduje obszar zerowej gęstości elektronowej między dwoma jądrami, znany jako płaszczyzna węzłowa (lub węzeł). Ten węzeł o zerowej gęstości elektronów destabilizuje się w kierunku wiązania, czyniąc go wyższą energią, a następnie ten typ orbitalu jest znany jako Orbital molekularny antybonding (oznaczany gwiazdką w nazwie orbitalu).
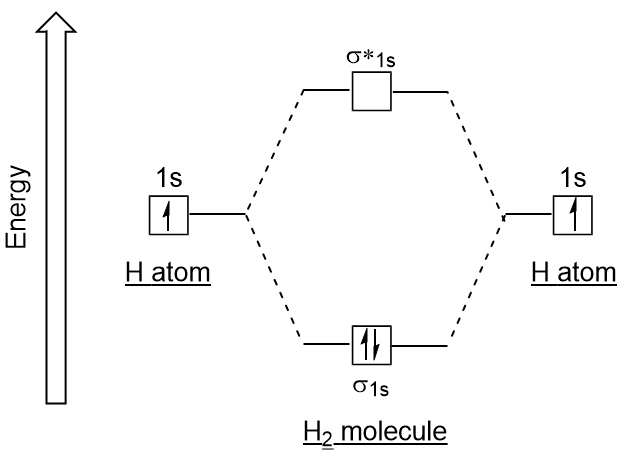
podobnie jak orbitale atomowe, możemy pisać diagramy energii konfiguracji elektronowej dla orbitali molekularnych (rysunek 9.20 „diagram energii konfiguracji elektronowej orbitali molekularnych wodoru”). Zauważ, że orbitale atomowe każdego atomu są zapisane po obu stronach, a nowo utworzone orbitale molekularne są zapisane w środku diagramu., Wiązanie orbitali molekularnych jest wypełnione i ma stosunkowo mniejszą energię niż wnoszące wkład orbitale atomowe, co potwierdza fakt, że cząsteczki wodoru (H2) są bardziej stabilne niż pojedyncze atomy wodoru.
kolejność wiązania
właśnie widzieliśmy, że Wiązanie Orbital cząsteczkowy jest niższa energia i sprzyja tworzeniu wiązania kowalencyjnego, podczas gdy antybonding Orbital cząsteczkowy jest wyższa energia z węzłem zerowej gęstości elektronowej między atomami, które destabilizuje tworzenie wiązania kowalencyjnego. Możemy ocenić siłę wiązania kowalencyjnego, określając jego kolejność wiązania.
kolejność wiązania = 1/2 (# elektronów w wiązaniu MOs – # elektronów w wiązaniu Mos)
wartości rzędu wiązania mogą być liczbami całkowitymi, ułamkami lub zerem., Wartości te odpowiadają modelowi wiązania walencyjnego, więc kolejność wiązania równa się 1 wiązaniu pojedynczemu, a 2 wiązaniu podwójnemu. Wartość zero oznacza, że nie ma wiązania, a Atomy istnieją oddzielnie.
przykład 11
Określ kolejność wiązań cząsteczki wodoru.
rozwiązanie
kolejność wiązania = 1/2 (# elektronów w wiązaniu MOs – # elektronów w wiązaniu Mos)
kolejność wiązania = 1/2 (2 – 0) = 1
dlatego w cząsteczce wodoru występuje pojedyncze Wiązanie.,
orbitale molekularne Li2
generowanie orbitali molekularnych cząsteczek bardziej złożonych niż wodór metodą LCAO wymaga zastosowania kilku dodatkowych wytycznych:
– liczba wygenerowanych MOs jest równa liczbie połączonych orbitali atomowych.
– połączone orbitale atomowe powinny mieć podobny poziom energetyczny.
– skuteczność atomowej kombinacji orbitalnej zależy od ilości nakładania się orbitali. Zwiększone nakładanie się obniża energię wiązania orbitalu molekularnego dalej i podnosi energię antybonding orbitalu molekularnego.,
zastosujmy się do tych wytycznych i wygenerujmy diagram konfiguracji orbitali molekularnych dla Li2 (rysunek 9.21 „diagram konfiguracji orbitali molekularnych dla dilitium”):
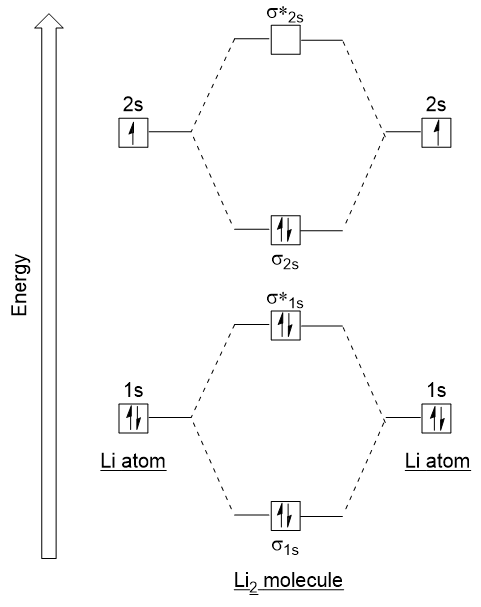
zauważ, że połączyliśmy orbitale atomowe 1s, jak wcześniej w przykładzie H2, aby wygenerować wiązanie i antybondowanie orbitali molekularnych, które są całkowicie wypełnione przez elektrony 1s obu atomów., Podobnie orbitale atomowe 2s łączą się, dając Orbital wiązania i orbital antybondingowy, które są wypełnione pozostałymi elektronami walencyjnymi począwszy od dołu do góry. Orbitale atomowe, które się łączą, mają podobny poziom energii; orbital 1s nie łączy się z jednym z orbitali 2s.
kolejność wiązań można wyznaczyć dla tej cząsteczki:
kolejność wiązań = 1/2 (4 – 2) = 1
dlatego Li2 miałby pojedynczą więź.,
orbitale molekularne z orbitali atomowych p
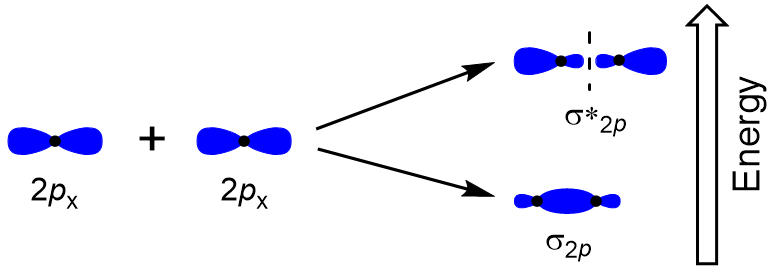
aby określić orbitale molekularne wielu innych cząsteczek, musimy zbadać, w jaki sposób orbitale p łączą się, aby dać orbitale molekularne. Orbitale p mogą nakładać się na siebie na dwa sposoby: głową w głowę lub bokiem. Nakładanie się orbitali atomowych P powoduje wiązanie i antybonding orbitali molekularnych, gdzie gęstość elektronów jest wyśrodkowana wzdłuż osi międzywojądrowej, co czyni je orbitalami σ (rysunek 9.22 „nakładanie się orbitali P od głowy do głowy”).
boczne nakładanie się pozostałych czterech orbitali atomowych P może wystąpić wzdłuż dwóch innych osi, generując cztery orbitale molekularne π o gęstości elektronowej po przeciwnych stronach osi międzywojądrowej(rysunek 9.23 „boczne nakładanie się orbitali P”).
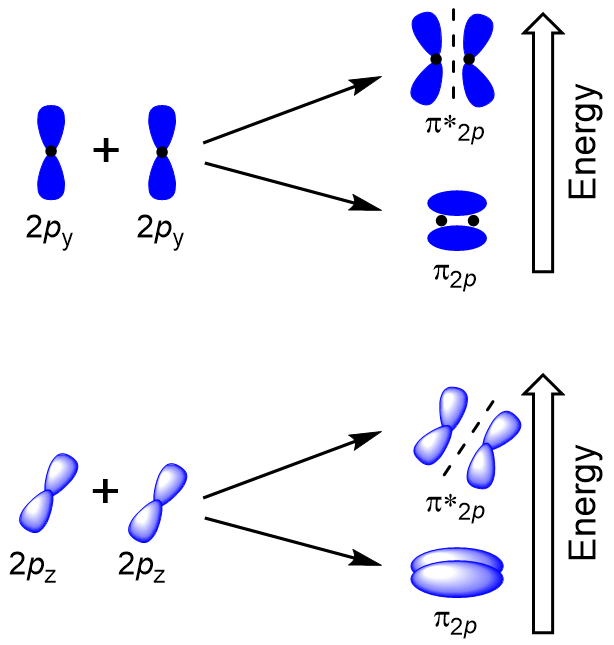
head-to-head nakładają się dając σ orbitale molekularne wyniki w większym nakładaniu się, czyniąc jego wiązania orbitali molekularnych najbardziej stabilne i najniższą energię, podczas gdy σ * antybonding jest najmniej stabilny i ma najwyższą energię(rysunek 9.24 „molekularny schemat energii orbitali dwuatomowych homonuklearnych cząsteczek wykonanych z atomów o liczbie atomowej 8-10”). Boki pokrywają się z czterema orbitalami molekularnymi π, dwoma orbitalami molekularnymi o niższej energii, oraz dwoma orbitalami antybondingowymi o wyższej energii.,
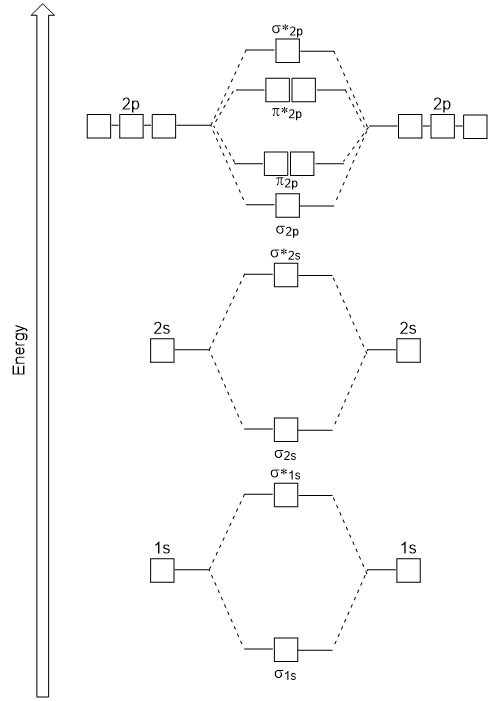
Wykres energii, który właśnie wygenerowaliśmy, pasuje eksperymentalnie do O2, F2 i Ne2, ale nie pasuje do B2, C2 i N2. W tym ostatnim, homonuklearne cząsteczki dwuatomowe (B2, C2 i N2), interakcje zachodzą między orbitalami atomowymi 2S i 2P, które są wystarczająco silne, aby zamienić kolejność orbitali molekularnych σ2p i N2P (rysunek 9.25).,
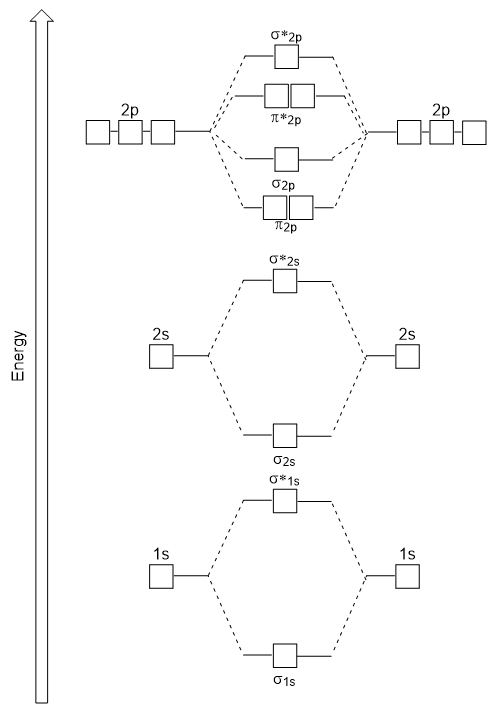
Heteronuklearne cząsteczki dwuatomowe
w heteronuklearnych cząsteczkach dwuatomowych, gdzie dwie różne cząsteczki są połączone, poziomy energetyczne poszczególnych atomów orbitali atomowych mogą się różnić. Jednak schemat orbitali molekularnych widzimy na rysunku 9.,25 („Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 5-7”) może być użyty do oszacowania konfiguracji elektronowej i porządku wiązania.
graniczne orbitale molekularne
możemy skupić się dalej na dwóch bardzo ważnych typach orbitali molekularnych: najwyższym zajmowanym orbitalu molekularnym (HOMO) i najniższym niezamieszkanym orbitalu molekularnym (LUMO), określanym również zbiorczo jako graniczne orbitale molekularne (rysunek 9.26 „graniczne orbitale molekularne HOMO i LUMO”)., Jak sugerują ich nazwy, HOMO jest orbitalem molekularnym, który ma najwyższą energię i zawiera elektrony, podczas gdy LUMO jest orbitalem molekularnym o najniższej energii, który nie zawiera elektronów.
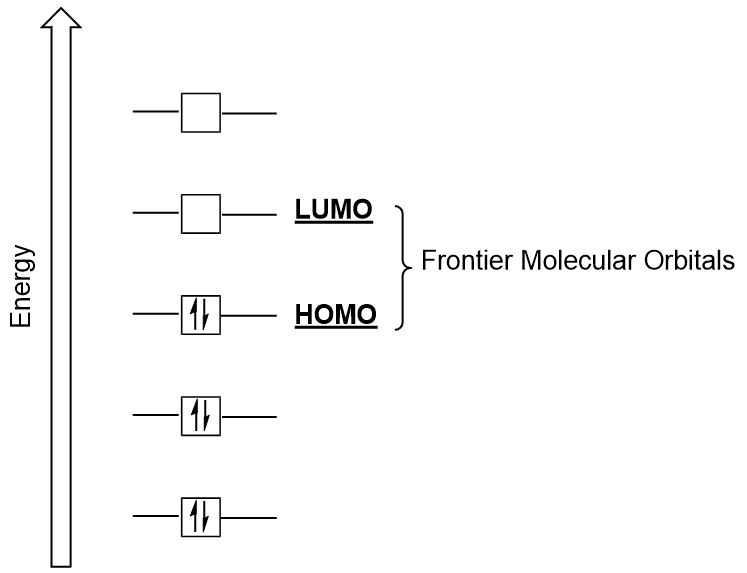
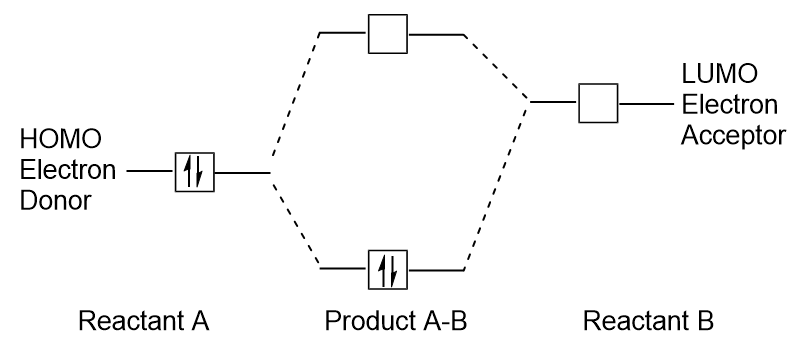
Kiedy cząsteczki absorbują energię, jest to typowe dla elektronu HOMO, aby użyć tej energii do przejścia z orbitalu ziemi HOMO do orbitalu stanu wzbudzonego LUMO., Ten rodzaj przejścia można zaobserwować w eksperymentach spektroskopii promieniowania ultrafioletowego (UV-VIS). Jak również, w wielu reakcjach chemicznych, jedna reagująca cząsteczka może oddawać elektrony HOMO do LUMO innego reagenta (rysunek 9.27 „Tworzenie nowego wiązania orbitalu molekularnego przez połączenie reagującego HOMO i LUMO”). Dlatego zrozumienie granicznych poziomów energii orbitali molekularnych może zapewnić chemikom wiele wglądu w obszary Spektroskopii Molekularnej i reaktywności.
kluczowe połączenia
- orbitale atomowe mogą łączyć się w celu wiązania i antybondowania orbitali molekularnych.
- orbitale wiązania mają mniejszą energię niż orbitale antybondingowe.
- orbitale molekularne wypełniane są na podobnych zasadach jak orbitale atomowe.
- kolejność wiązania może być używana do oceny siły wiązania.
- przygraniczne orbitale molekularne mają szczególne znaczenie w spektroskopii molekularnej i reaktywności.