Learning Objectives
- krijg inzicht in de moleculaire orbitale theorie.
- leer obligatieorders te berekenen.
- leer energiediagrammen voor moleculaire orbitale elektronenconfiguratie te tekenen.
Valentiebindingstheorie kan vele aspecten van binding verklaren, maar niet alle. Om deze theorie aan te vullen, gebruiken we een andere, de moleculaire orbitale (MO) theorie., De moleculaire orbitale theorie is een geavanceerder model voor het begrijpen van de aard van chemische binding.
MO-theorie brengt het idee van atomaire orbitalen die elkaar overlappen naar een nieuw niveau, waar nieuwe moleculaire orbitalen worden gegenereerd met behulp van een wiskundig proces dat lineaire combinatie van atomaire orbitalen (lcao) wordt genoemd.
moleculaire orbitalen hebben veel overeenkomsten met atomaire orbitalen:
– ze worden gevuld van laagste tot hoogste energie (Aufbau-Principe).
– ze kunnen maximaal twee elektronen met tegengestelde spin per orbitaal bevatten (Pauli-uitsluitingsprincipe).,
het belangrijkste verschil tussen atomaire en moleculaire orbitalen is dat atomaire orbitalen elektronendichtheid vertegenwoordigen in de ruimte geassocieerd met een bepaald atoom. De moleculaire orbitalen worden geassocieerd met de volledige molecuul, betekenend wordt de elektronendichtheid gedelokaliseerd (uitgespreid) over meer dan één atoom.
de moleculaire orbitalen van het waterstofmolecuul
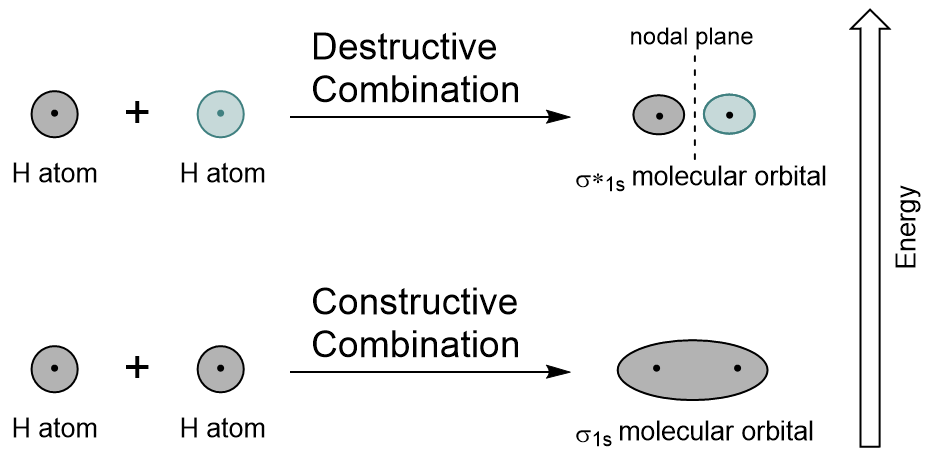
door de 1s orbitalen van elk waterstofatoom te combineren met LCAO worden twee moleculaire orbitalen gegenereerd σ1s (uitgesproken sigma one s) en σ*1s (uitgesproken sigma star one S).,
De σ1s-orbitaal wordt gegenereerd door een constructieve combinatie (of interferentie), waarbij de twee atomaire orbitalen golffuncties elkaar versterken (optellen). Dit is de lagere energie van de twee moleculaire orbitalen en staat bekend als de binding moleculaire orbitaal. Merk op in Figuur 9.19 “Hydrogen molecular orbital combination diagram” dat de elektronendichtheid van deze orbitaal is geconcentreerd tussen de twee kernen. Deze elektronen worden gestabiliseerd door aantrekkingen aan beide kernen, en ze houden de atomen samen met een covalente binding.,
De σ * 1s-orbitaal wordt gegenereerd door een destructieve combinatie (of interferentie), waarbij de golffuncties van de twee atomaire orbitalen elkaar opheffen. Dit type combinatie resulteert in een gebied van nul elektrondichtheid tussen de twee kernen, bekend als een knooppuntvlak (of knoop). Dit knooppunt van nul elektronendichtheid destabiliseert naar de binding, waardoor het een hogere energie krijgt, en vervolgens staat dit type orbitaal bekend als een antibonding moleculaire orbitaal (aangeduid met de asterisk in de orbitale naam).
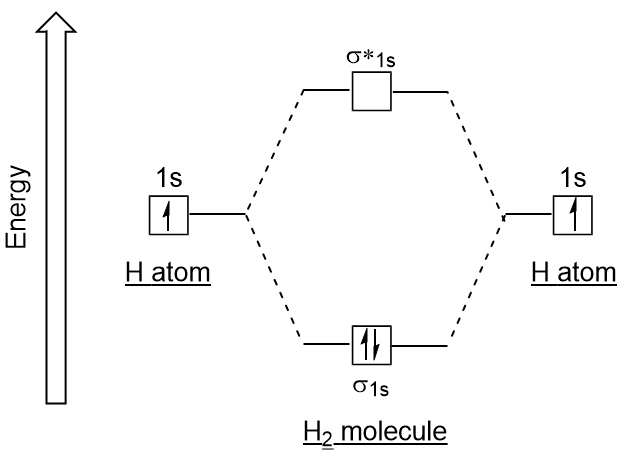
vergelijkbaar met atomaire orbitalen kunnen we elektronenconfiguratie energiediagrammen schrijven voor moleculaire orbitalen (figuur 9.20 “Hydrogen molecular orbital electron configuration energy diagram”). Merk op dat de atomaire orbitalen van elk atoom aan weerszijden zijn geschreven, en de nieuw gevormde moleculaire orbitalen in het midden van het diagram zijn geschreven., De binding moleculaire orbitaal is gevuld en is relatief lager in energie dan de bijdragende atomaire orbitalen, wat het feit ondersteunt dat waterstofmoleculen (H2) stabieler zijn dan eenzame waterstofatomen.
bindingsvolgorde
we hebben zojuist gezien dat de bindingsmoleculaire orbitaal lagere energie is en de vorming van een covalente binding bevordert, terwijl de antibondende moleculaire orbitaal hogere energie is met een knoop van nul elektrondichtheid tussen de atomen die de vorming van een covalente binding destabiliseert. We kunnen de sterkte van een covalente binding evalueren door de bindingsvolgorde te bepalen.
bindingsvolgorde = 1/2 (#van elektronen in bonding MOs – # van elektronen in antibonding MOs)
bindingsvolgorde waarden kunnen hele getallen, breuken of nul zijn., Deze waarden komen overeen met het valentiebindingsmodel, dus een bindingsorde van 1 is gelijk aan een enkele binding, en 2 is gelijk aan een dubbele binding. Een waarde van nul betekent dat er geen binding aanwezig is, en de atomen afzonderlijk bestaan.
voorbeeld 11
Bepaal de bindingsvolgorde van het waterstofmolecuul.
oplossing
bindingsvolgorde = 1/2 (#van elektronen in bindingsmos – # van elektronen in antibondingmos)
bindingsvolgorde = 1/2 (2 – 0) = 1
daarom is er een enkele binding in het waterstofmolecuul.,
moleculaire orbitalen van Li2
genereren van moleculaire orbitalen van moleculen complexer dan waterstof met behulp van de lcao– methode vereist het volgen van een paar extra richtlijnen:
– Het aantal gegenereerde MOs is gelijk aan het aantal atomaire orbitalen gecombineerd.
– gecombineerde atomaire orbitalen moeten vergelijkbare energieniveaus hebben.
– de effectiviteit van atomaire orbitale combinatie hangt af van de hoeveelheid orbitale overlapping. Verhoogde overlap verlaagt de energie van de binding moleculaire orbitaal verder, en verhoogt de energie van de antibonding moleculaire orbitaal.,
laten we deze richtlijnen volgen en een molecular orbital electron configuration diagram genereren voor Li2 (figuur 9.21 “Molecular orbital electron configuration energy diagram for dilithium”):
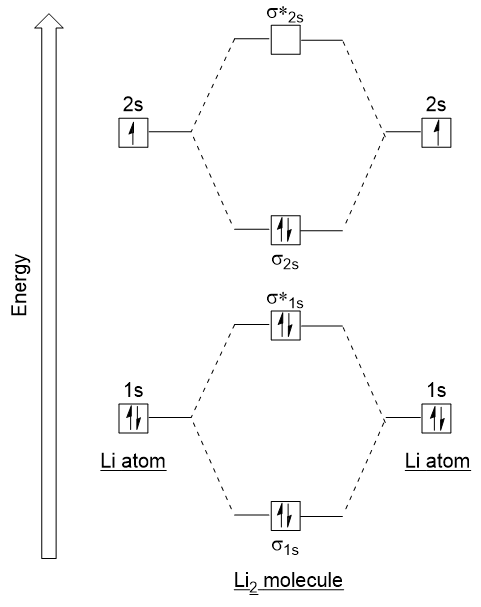
merk op dat we de 1s atomaire orbitalen hebben gecombineerd, zoals eerder in het H2-voorbeeld, om binding en antibonding moleculaire orbitalen te genereren die volledig gevuld zijn met de 1s-elektronen van beide atomen., Op dezelfde manier combineren 2S atomaire orbitalen, waardoor een binding orbitaal en een antibonding orbitaal, die worden gevuld met de resterende valentie-elektronen vanaf de bodem naar boven. De atomaire orbitalen die samengaan zijn van vergelijkbare energieniveaus; een 1s orbitaal combineert niet met een van de 2S orbitalen.
de bindingsvolgorde kan voor dit molecuul worden bepaald als:
bindingsvolgorde = 1/2 (4 – 2) = 1
daarom zou Li2 één enkele binding hebben.,
moleculaire orbitalen van P atomaire orbitalen
om de moleculaire orbitalen van vele andere moleculen te bepalen, moeten we onderzoeken hoe p-orbitalen combineren om moleculaire orbitalen te geven. De p-orbitalen kunnen elkaar op twee manieren overlappen: head-to-head of zijwaarts. Head-to-head overlapping van P atomaire orbitalen resulteert in een binding en antibonding moleculaire orbitaal, waar de elektrondichtheid gecentreerd langs de internucleaire as, waardoor ze σ orbitalen (figuur 9.22 “Head-to-head overlapping van p orbitalen”).
zijwaartse overlapping van de resterende vier P-atomaire orbitalen kan optreden langs de twee andere assen, waardoor vier π moleculaire orbitalen met elektronendichtheid aan weerszijden van de internucleaire as worden gegenereerd (figuur 9.23″zijwaartse overlapping van p-orbitalen”).
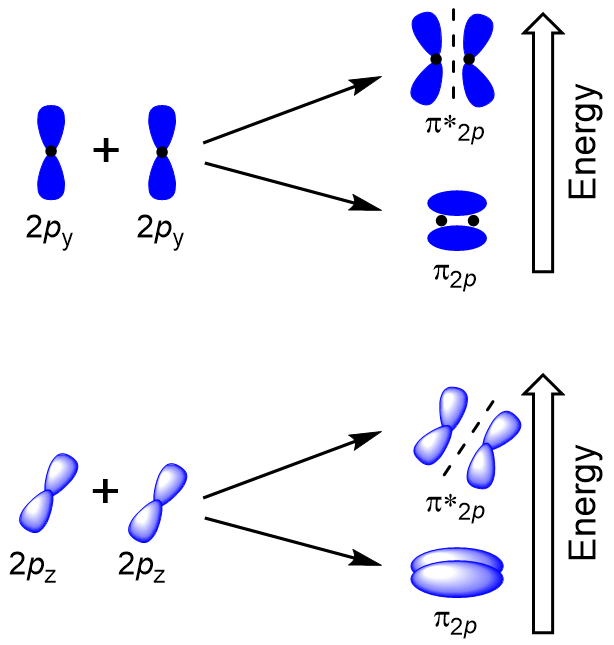
De head-to-head overlap Die σ moleculaire orbitalen geeft, resulteert in een grotere overlap, waardoor de moleculaire orbitale binding de meest stabiele en laagste energie is, terwijl de σ * antibonding het minst stabiel is en de hoogste energie heeft (figuur 9.24 “Molecular orbital energy diagram for homonuclear diatomic moleculen made from Atomic number 8-10”). Zijwaartse overlapping geeft vier π moleculaire orbitalen, twee lagere-energie degeneraat-binding moleculaire orbitalen, en twee hogere-energie antibonding orbitalen.,
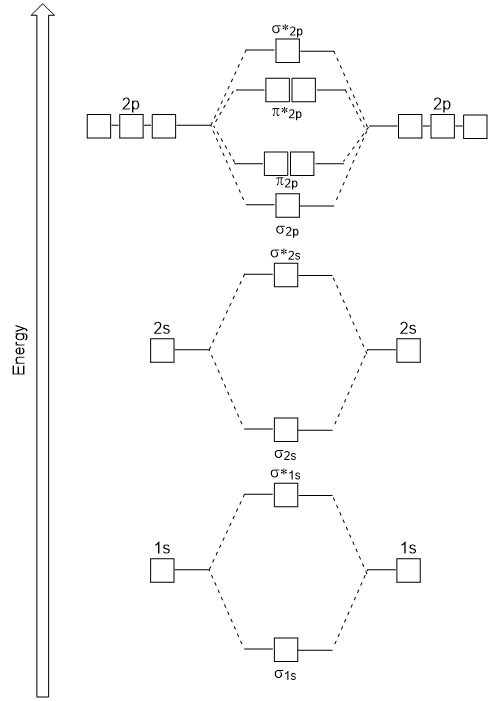
het energiediagram dat we zojuist hebben gegenereerd past experimenteel met O2, F2 en Ne2, maar past niet voor B2, C2 en N2. In de laatste, homonucleaire diatomaire moleculen (B2, C2 en N2), vinden interacties plaats tussen de 2s en 2P atomaire orbitalen die sterk genoeg zijn om de volgorde van de σ2p en n2p moleculaire orbitalen te verwisselen (figuur 9.25).,
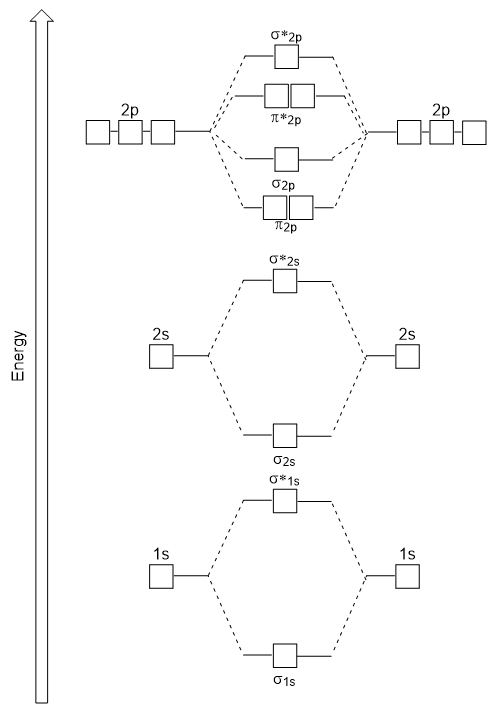
Heteronucleaire Diatomaire moleculen
in heteronucleaire diatomaire moleculen, waarbij twee verschillende moleculen zijn gebonden, kunnen de energieniveaus van de atomaire orbitalen van de afzonderlijke atomen verschillen. Echter, het moleculaire orbitale diagram zien we in Figuur 9.,25 (“Molecular orbital energy diagram for homonuclear diatomic moleculen made from atoms of atomic number 5-7”) kan worden gebruikt om de elektronenconfiguratie en bindingsvolgorde te schatten.
Frontier moleculaire orbitalen
We kunnen ons verder richten op twee zeer belangrijke types van moleculaire orbitalen: de hoogste bezette moleculaire orbitaal (HOMO) en de laagste onbezette moleculaire orbitaal (LUMO), ook gezamenlijk aangeduid als de frontier moleculaire orbitalen (figuur 9.26 “Frontier moleculaire orbitalen HOMO en LUMO”)., Zoals hun namen impliceren, is de HOMO de moleculaire orbitaal die de hoogste energie heeft en elektronen bevat, terwijl de LUMO de laagste energie moleculaire orbitaal is die geen elektronen bevat.
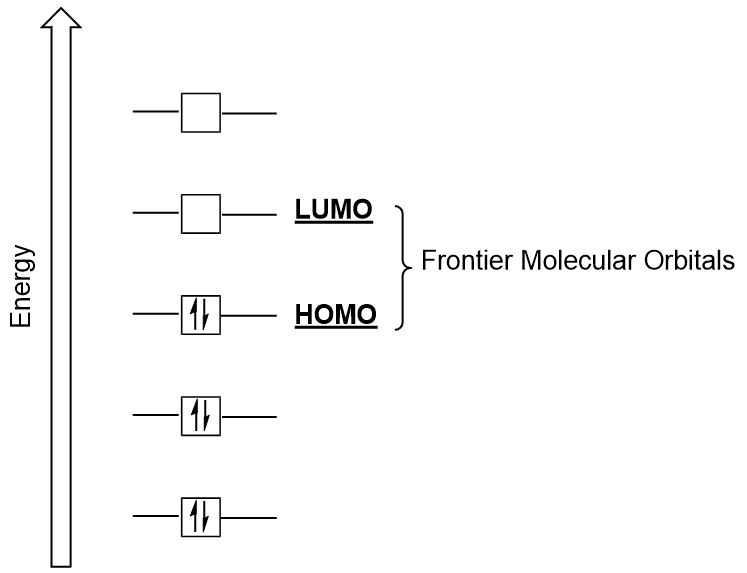
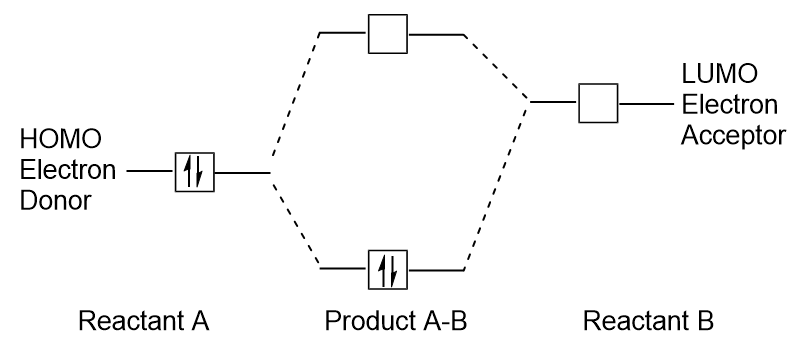
wanneer moleculen energie absorberen, is het typisch voor een HOMO-elektron om deze energie te gebruiken om van de grond HOMO orbitaal naar de LUMO opgewonden-state orbitaal., Dit type van overgang kan worden waargenomen in ultraviolet-zichtbare (UV-Vis) straling spectroscopie experimenten. In veel chemische reacties kan een reactieve molecule HOMO-elektronen doneren aan het LUMO van een andere reactieve stof (figuur 9.27 “vorming van een nieuwe binding moleculaire orbitaal door het combineren van reactieve HOMO en LUMO”). Daarom, kan het begrijpen van grens moleculaire orbitale energieniveaus chemici van een groot deel van inzicht op het gebied van moleculaire spectroscopie en reactiviteit voorzien.
Key Takeaways
- atomaire orbitalen kunnen worden gecombineerd om binding en antibonding moleculaire orbitalen te maken.
- bindings-orbitalen hebben een lagere energie dan antibondende orbitalen.
- moleculaire orbitalen worden gevuld volgens vergelijkbare principes als atomaire orbitalen.
- bindingsvolgorde kan worden gebruikt om de bindingssterkte te evalueren.
- Grensmoleculaire orbitalen zijn van bijzonder belang in moleculaire spectroscopie en reactiviteit.