Mål
- Få en forståelse av molecular orbital teori.
- Lære å beregne bond bestillinger.
- Lær å tegne molecular orbital electron-konfigurasjonen energi-diagrammer.
Valence bond theory er i stand til å forklare mange aspekter av bonding, men ikke alle. For å komplettere denne teorien, bruker vi en annen kalt molecular orbital (MO) teori., Molecular orbital teori er en mer sofistikert modell for å forstå arten av kjemisk binding.
MO-teori tar ideen av atom-orbitals overlappende til et nytt nivå, der nye molekylære orbitals er generert ved hjelp av en matematisk prosess som kalles lineær kombinasjon av atom-orbitals (LCAO).
Molekylær orbitals deler mange likheter med atomic orbitals:
– De er fylt fra lavest energi til å høyeste energi (Aufbau-prinsippet).
– De kan ha maksimalt to elektroner i motsatt spinn per orbital (Pauli exclusion principle).,
Den største forskjellen mellom atomære og molekylære orbitals er at atom-orbitals representerer electron tetthet i verdensrommet forbundet med en bestemt atom. Molekylær orbitals er forbundet med hele molekylet, som betyr at elektronet tetthet er delocalized (spredt) over mer enn ett atom.
De Molekylære Orbitals av Hydrogen Molekyl
ved å Kombinere 1s orbitals av hver hydrogenatom med LCAO, to molecular orbitals er generert σ1s (uttales sigma one s) og σ*1s (uttales sigma star one s).,
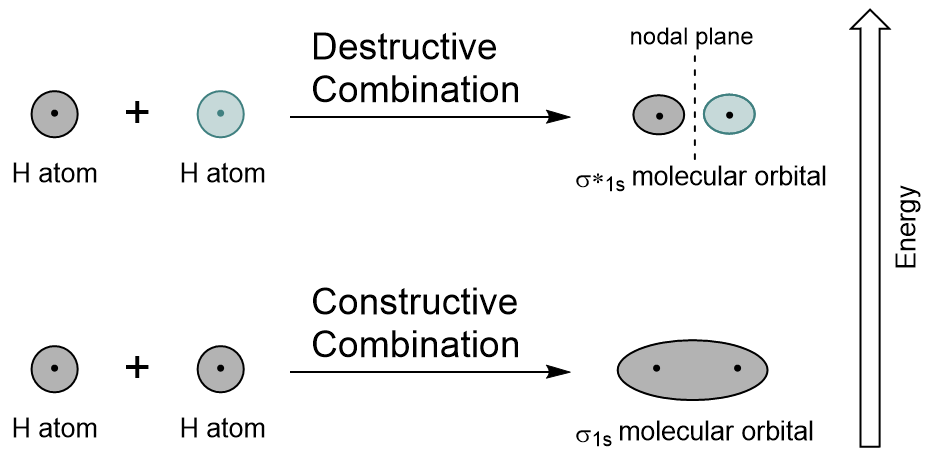
σ1s orbital er generert av en konstruktiv kombinasjon (eller forstyrrelser), der de to atom-orbitals bølge funksjoner forsterke (legg til) hver andre. Dette er lavere energi av de to molecular orbitals og er kjent som bonding molecular orbital. Legg merke til i Figur 9.19 «Hydrogen molecular orbital kombinasjon diagram» at elektronet tetthet av dette orbital er konsentrert mellom de to kjerner. Disse elektronene er stabilisert av attraksjoner for både kjerner, og de holder atomene sammen med en covalent bond.,
σ*1s orbital er generert av en destruktiv kombinasjon (eller forstyrrelser), der bølgen funksjoner av to atom-orbitals avbryte hverandre. Denne type kombinasjon resultater i et område av null electron tetthet mellom de to kjerner, kjent som en nodal flyet (eller nodenavn). Denne noden til null electron tetthet er destabiliserende mot bond, noe som gjør det høyere energi, og senere denne type orbital er kjent som en antibonding molecular orbital (merket med stjerne i orbital navn).
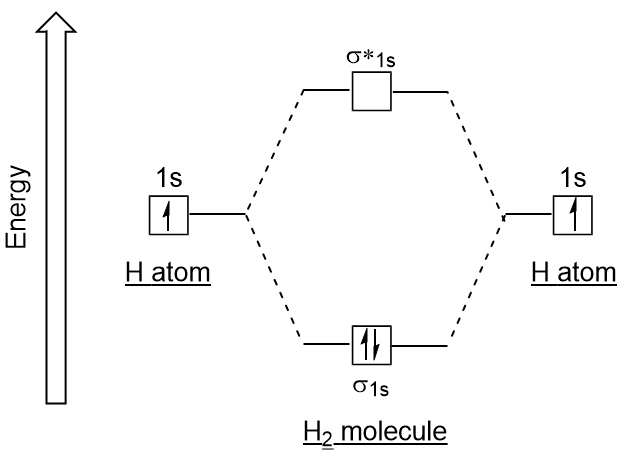
Lik atomic orbitals, kan vi skrive electron-konfigurasjonen energi-diagrammer for molekylær orbitals (Figur 9.20 «Hydrogen molecular orbital electron-konfigurasjonen energi diagram»). Legg merke til at atom-orbitals av hvert atom er skrevet på hver side, og den nyopprettede molekylær orbitals er skrevet i sentrum av diagrammet., Bonding molecular orbital er fylt ut og er relativt lavere energi enn de bidrar atomic orbitals, som støtter det faktum at hydrogen-molekyler (H2) er mer stabil enn lone hydrogen atomer.
Bond Order
Vi har nettopp sett at binding molecular orbital er lavere energi og fremmer dannelsen av en covalent bond, mens antibonding molecular orbital er høyere energi med en node av null electron tetthet mellom atomene som desta-bi-lizes dannelsen av en covalent bond. Vi kan vurdere styrken av en covalent bond ved å bestemme sin obligasjons-ordre.
Bond order = 1/2 (antall elektroner i bonding MOs – antall elektroner i antibonding MOs)
Bond-for verdier kan være hele tall, brøker, eller null., Disse verdiene tilsvarer valence bond-modell, slik at en bond størrelsesorden 1 er lik en enkelt obligasjon, og 2 er lik en dobbel binding. En verdi på null, betyr det at det er ingen obligasjon til stede, og atomene eksistere separat.
Eksempel 11
Finne bond for hydrogen-molekylet.
Løsningen
Bond order = 1/2 (antall elektroner i bonding MOs – antall elektroner i antibonding MOs)
Bond ordre = 1/2 (2 – 0) = 1
Derfor det er en enkelt obligasjon i hydrogen-molekylet.,
Molekylær Orbitals av Li2
Generere molekylær orbitals av molekyler som er mer komplekse enn hydrogen ved hjelp av LCAO metoden krever at du følger et par ytterligere retningslinjer:
– antall MOs generert er lik antall av atom-orbitals kombinert.
– Kombinert atomic orbitals bør være lik energi nivåer.
– effektiviteten av atomic orbital kombinasjon avhenger av mengden av orbital overlapper hverandre. Økt overlapp senker energi av bonding molecular orbital videre, og høyner energien for antibonding molecular orbital.,
La oss følge disse retningslinjene, og du vil generere en molecular orbital electron-konfigurasjonen diagram for Li2 (Figur 9.21 «Molecular orbital electron-konfigurasjonen energi-diagram for dilithium»):
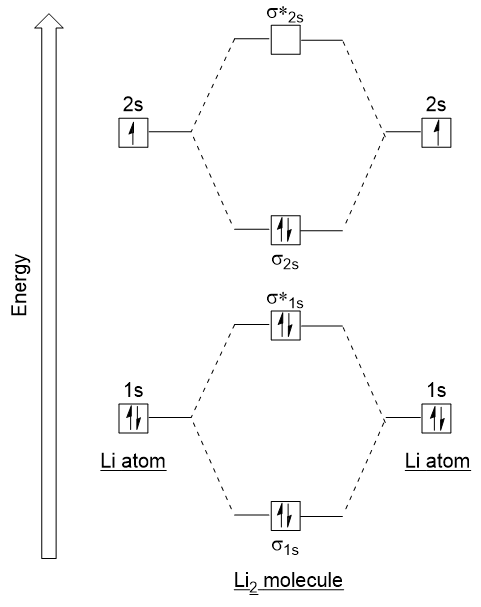
legg Merke til at vi har kombinert 1s atomic orbitals, som før i H2 eksempel for å generere bonding og antibonding molekylær orbitals som er helt fylt av både atomer’ 1s elektroner., På samme måte 2s atomic orbitals kombinere, noe som gir en binding orbital og en antibonding orbital, som er fylt med de resterende valence elektroner fra bunnen og opp. Atom-orbitals, som kombinerer en er av tilsvarende energi nivåer; en 1s orbital ikke kombinere med en av de 2s orbitals.
The bond bestilling kan fastsettes for dette molekylet til å være:
Bond ordre = 1/2 (4 – 2) = 1
Derfor Li2 ville ha en enkelt obligasjon.,
Molekylær Orbitals fra s Atomic Orbitals
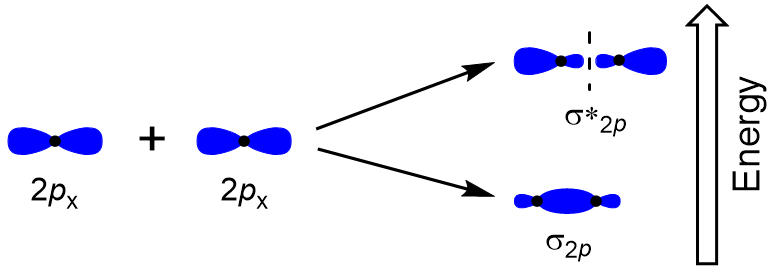
for Å finne molekylære orbitals av mange andre molekyler, trenger vi å undersøke hvordan p-orbitals kombineres for å gi molekylær orbitals. P-orbitals kan overlappe på to måter: head-to-head eller sidelengs. Head-to-Head overlapping av s atomic orbitals resulterer i en bonding og antibonding molecular orbital, hvor elektronet tetthet er sentrert langs internuclear aksen, noe som gjør dem σ orbitals (Figur 9.22 «Head-to-Head overlapping av p-orbitals»).
Sidelengs overlapping av de resterende fire p atomic orbitals kan oppstå langs de to andre aksene, generere fire π molekylær orbitals å ha electron tetthet på motsatte sider av internuclear aksen (Figur 9.23 «Sidelengs overlapping av p-orbitals»).
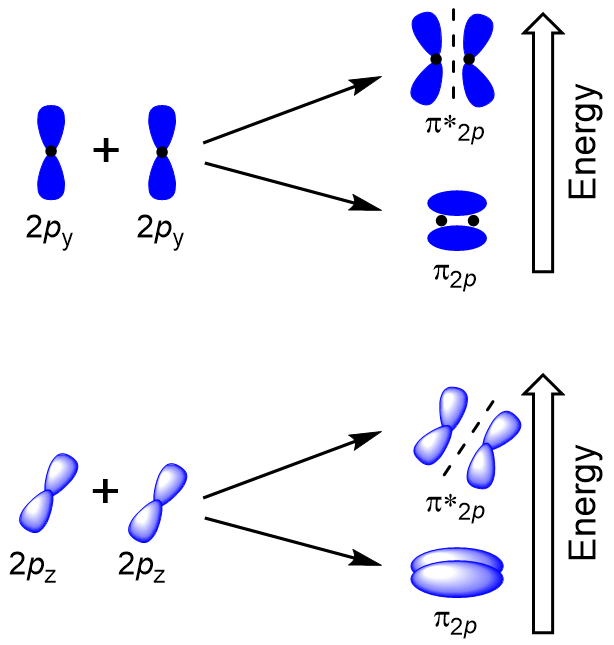
head-to-head overlapp gir σ molekylær orbitals resultater i større overlapp, noe som gjør sin liming molecular orbital den mest stabile og lavest energi, mens σ* antibonding er minst stabil og har den høyeste energi (Figur 9.24 «Molecular orbital energi-diagram for homonuclear diatomic molekyler som er laget av atomer av atomnummer 8-10»). Sidelengs overlapp gir fire π molekylær orbitals, to lavere energi utarte-bonding molekylær orbitals, og to høyere energi antibonding orbitals.,
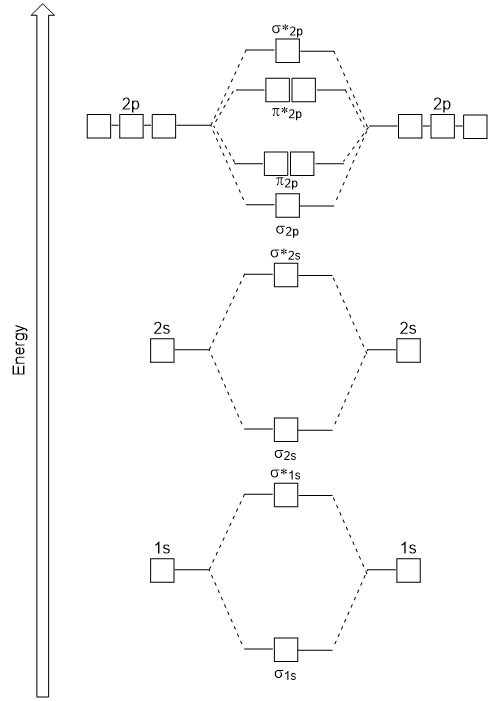
energi-diagrammet har vi bare generert passer eksperimentelt med O2, F2, og Ne2, men passer ikke for B2, C2, og N2. I det siste, homonuclear diatomic molekyler (B2, C2, og N2), interaksjoner som finner sted mellom 2s og 2p atomic orbitals som er sterk nok til å bytte bestilling av σ2p og n2p molekylær orbitals (Figur 9.25).,
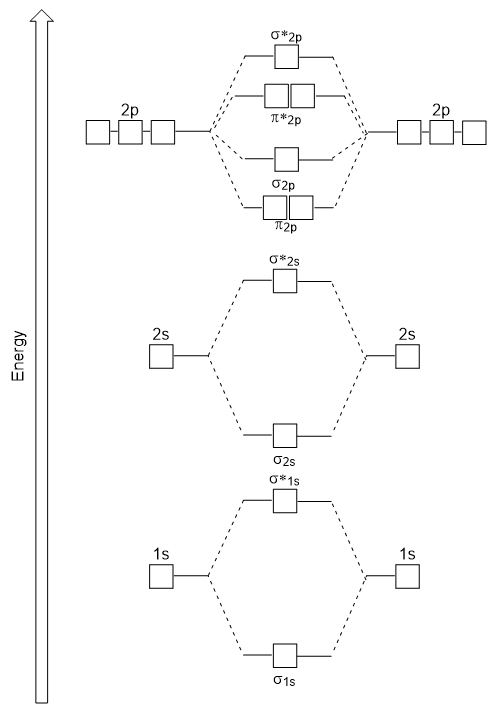
Heteronuclear Diatomic Molekyler
I heteronuclear diatomic molekyler, hvor to forskjellige molekyler som er bundet, energi nivåer av individuelle atomer’ atom-orbitals kan variere. Men, molecular orbital diagrammet ser vi i Figur 9.,25 («Molecular orbital energi-diagram for homonuclear diatomic molekyler som er laget av atomer av atomnummer 5-7») kan brukes til å anslå den electron-konfigurasjonen og bond ordre.
Frontier Molekylær Orbitals
Vi kan fokusere ytterligere på to svært viktige typer av molekylære orbitals: den høyeste okkuperte molecular orbital (HOMO), og den laveste ledige molecular orbital (LUMO), også omtalt samlet som frontier molekylær orbitals (Figur 9.26 «Frontier molekylær orbitals HOMO og LUMO»)., Som navnene antyder, den HOMO er molecular orbital som har den høyeste energi og inneholder elektroner, mens LUMO er lavest energi molecular orbital som ikke inneholder elektroner.
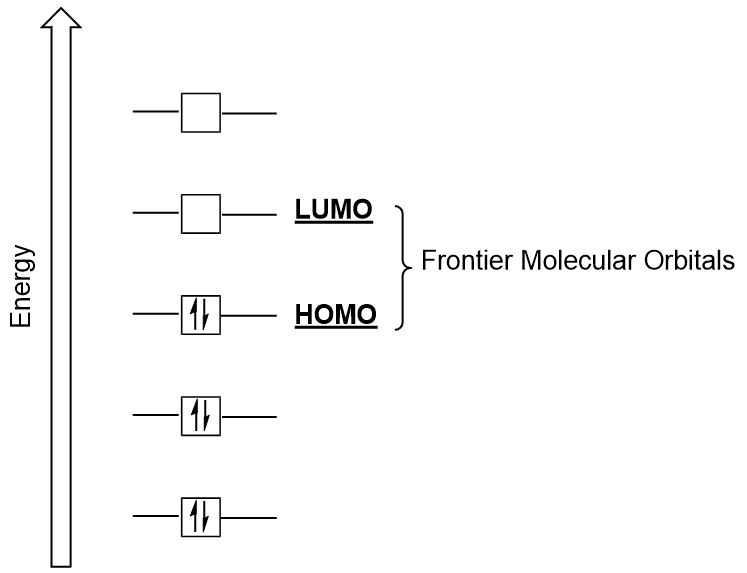
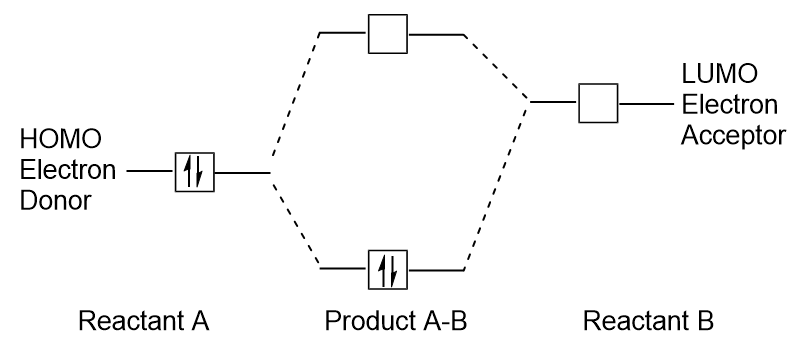
Når molekyler absorberer energi, det er typisk for en HOMO electron å bruke denne energien til overgangen fra første HOMO orbital til LUMO spent state-orbital., Denne typen overgang kan bli observert i uv-synlig (UV-Vis) stråling spektroskopi eksperimenter. I tillegg, i mange kjemiske reaksjoner, en reaktant molekyl kan gi HOMO elektroner til LUMO av en annen reaktant (Figur 9.27 «Dannelsen av en ny bonding molecular orbital ved å kombinere reaktant HOMO og LUMO»). Derfor, forstå frontier molecular orbital energi nivåer kan gi kjemikere med stor grad av innsikt i de områdene av molekylær spektroskopi og reaktivitet.
– Tasten Takeaways
- Atomic orbitals kan kombineres for å gjøre bonding og antibonding molekylær orbitals.
- Bonding orbitals er lavere energi enn antibonding orbitals.
- Molekylær orbitals er fylt med lignende prinsipper for å atomic orbitals.
- Bond bestilling kan brukes til å vurdere bond styrke.
- Frontier molekylær orbitals er av særlig betydning i molekylær spektroskopi og reaktivitet.