Obiettivi formativi
- Acquisire una comprensione della teoria degli orbitali molecolari.
- Impara a calcolare gli ordini obbligazionari.
- Impara a disegnare diagrammi energetici di configurazione elettronica orbitale molecolare.
La teoria del legame di valenza è in grado di spiegare molti aspetti del legame, ma non tutti. Per completare questa teoria, ne usiamo un’altra chiamata teoria degli orbitali molecolari (MO)., La teoria degli orbitali molecolari è un modello più sofisticato per comprendere la natura del legame chimico.
La teoria MO prende l’idea di orbitali atomici sovrapposti ad un nuovo livello, dove nuovi orbitali molecolari vengono generati utilizzando un processo matematico chiamato combinazione lineare di orbitali atomici (LCAO).
Gli orbitali molecolari condividono molte somiglianze con gli orbitali atomici:
– Sono riempiti dall’energia più bassa all’energia più alta (principio Aufbau).
– Possono contenere un massimo di due elettroni di spin opposto per orbitale (principio di esclusione di Pauli).,
La principale differenza tra orbitali atomici e molecolari è che gli orbitali atomici rappresentano la densità elettronica nello spazio associato a un particolare atomo. Gli orbitali molecolari sono associati all’intera molecola, il che significa che la densità elettronica è delocalizzata (distribuita) su più di un atomo.
Gli orbitali molecolari della molecola di idrogeno
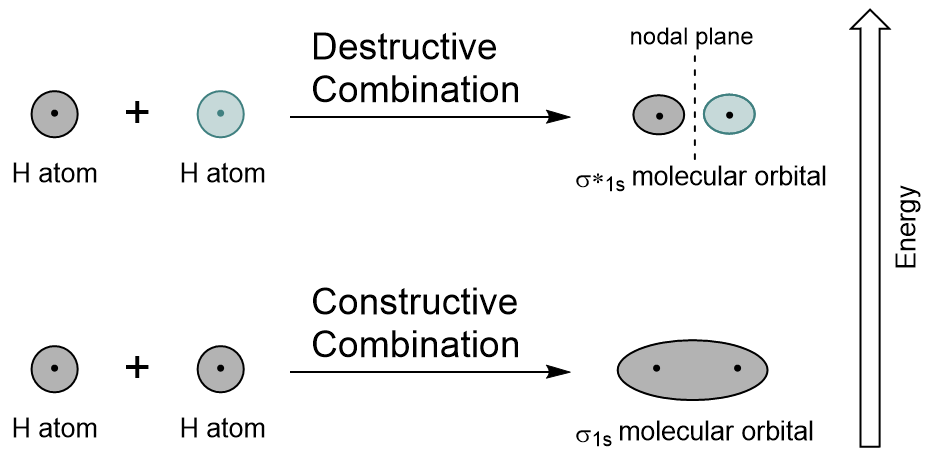
Combinando gli orbitali 1s di ciascun atomo di idrogeno usando LCAO, vengono generati due orbitali molecolari σ1s (pronunciato sigma one s) e σ*1s (pronunciato sigma star one s).,
L’orbitale σ1s è generato da una combinazione costruttiva (o interferenza), in cui le due funzioni d’onda degli orbitali atomici si rafforzano (si aggiungono) a vicenda. Questa è l’energia più bassa dei due orbitali molecolari ed è nota come orbitale molecolare di legame. Si noti nella Figura 9.19 “Diagramma di combinazione orbitale molecolare dell’idrogeno” che la densità elettronica di questo orbitale è concentrata tra i due nuclei. Questi elettroni sono stabilizzati dalle attrazioni di entrambi i nuclei e tengono gli atomi insieme con un legame covalente.,
L’orbitale σ*1s è generato da una combinazione distruttiva (o interferenza), dove le funzioni d’onda dei due orbitali atomici si annullano a vicenda. Questo tipo di combinazione si traduce in un’area di densità elettronica zero tra i due nuclei, nota come piano nodale (o nodo). Questo nodo di densità elettronica zero è destabilizzante verso il legame, rendendolo più alta energia, e successivamente questo tipo di orbitale è noto come orbitale molecolare antibonding (indicato dall’asterisco nel nome orbitale).
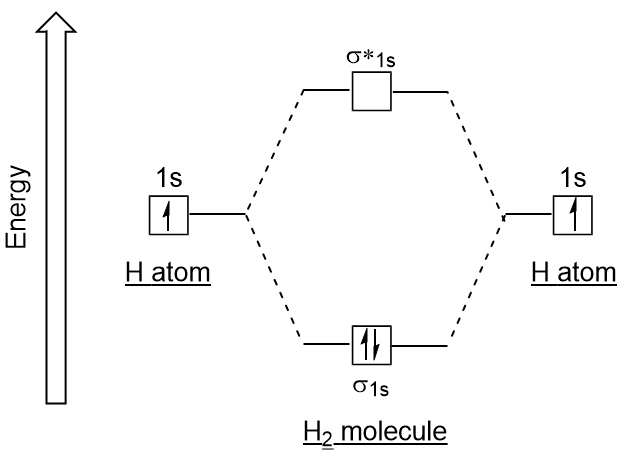
Analogamente agli orbitali atomici, possiamo scrivere diagrammi di energia di configurazione elettronica per orbitali molecolari (Figura 9.20 “Diagramma di energia di configurazione elettronica molecolare dell’idrogeno”). Si noti che gli orbitali atomici di ciascun atomo sono scritti su entrambi i lati e gli orbitali molecolari appena formati sono scritti al centro del diagramma., L’orbitale molecolare di legame è riempito ed è relativamente più basso in energia rispetto agli orbitali atomici che contribuiscono, sostenendo il fatto che le molecole di idrogeno (H2) sono più stabili degli atomi di idrogeno solitari.
Ordine di legame
Abbiamo appena visto che l’orbitale molecolare di legame è di energia inferiore e favorisce la formazione di un legame covalente, mentre l’orbitale molecolare antibonding è di energia superiore con un nodo di densità elettronica zero tra gli atomi che destabilizza la formazione di un legame covalente. Possiamo valutare la forza di un legame covalente determinando il suo ordine di legame.
Ordine di legame = 1/2 (# di elettroni nel MOs di legame – # di elettroni nel MOs antibonding)
I valori dell’ordine di legame possono essere numeri interi, frazioni o zero., Questi valori corrispondono al modello di legame di valenza, quindi un ordine di legame di 1 è uguale a un singolo legame e 2 è uguale a un doppio legame. Un valore di zero significa che non c’è legame presente e gli atomi esistono separatamente.
Esempio 11
Determinare l’ordine di legame della molecola di idrogeno.
Soluzione
Ordine di legame = 1/2 (#di elettroni in MOS di legame – # di elettroni in MOs antibonding)
Ordine di legame = 1/2 (2 – 0) = 1
Quindi c’è un singolo legame nella molecola di idrogeno.,
Orbitali molecolari di Li2
Generare orbitali molecolari di molecole più complesse dell’idrogeno utilizzando il metodo LCAO richiede di seguire alcune linee guida aggiuntive:
– Il numero di MOS generati è uguale al numero di orbitali atomici combinati.
– Gli orbitali atomici combinati dovrebbero avere livelli di energia simili.
– L’efficacia della combinazione orbitale atomica dipende dalla quantità di sovrapposizione orbitale. L’aumento della sovrapposizione abbassa ulteriormente l’energia dell’orbitale molecolare di legame e aumenta l’energia dell’orbitale molecolare antibonding.,
Seguiamo queste linee guida e generiamo un diagramma di configurazione elettronica orbitale molecolare per Li2 (Figura 9.21 “Diagramma energetico di configurazione elettronica orbitale molecolare per dilitio”):
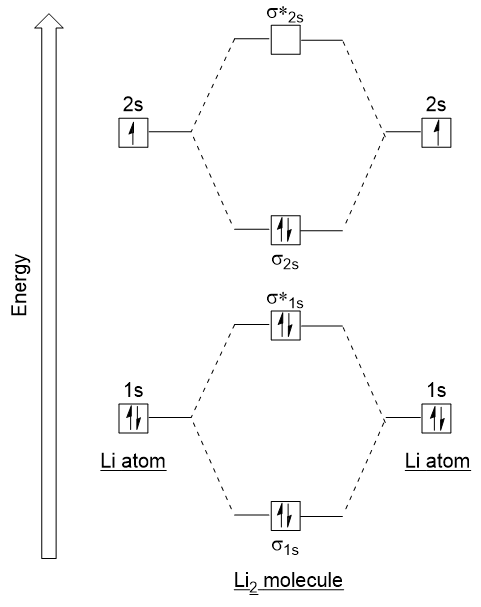
Si noti che abbiamo combinato gli orbitali atomici 1s, come prima nell’esempio H2, per generare orbitali molecolari di legame e antibonding che sono completamente riempiti dagli elettroni 1s di entrambi gli atomi., Allo stesso modo gli orbitali atomici 2s si combinano, dando un orbitale di legame e un orbitale antibonding, che sono riempiti con gli elettroni di valenza rimanenti a partire dal basso verso l’alto. Gli orbitali atomici che si combinano sono di livelli di energia simili; un orbitale 1s non si combina con uno degli orbitali 2s.
L’ordine di legame può essere determinato perché questa molecola sia:
Ordine di legame = 1/2 (4 – 2) = 1
Quindi Li2 avrebbe un singolo legame.,
Orbitali molecolari da p Orbitali atomici
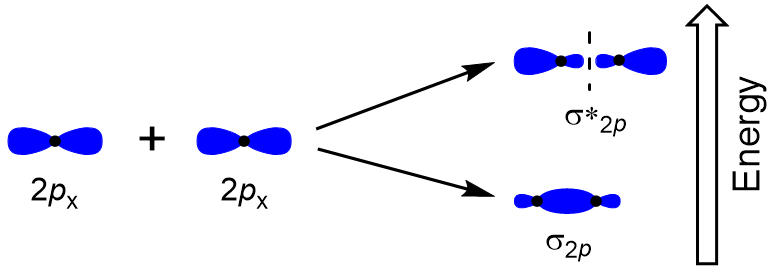
Per determinare gli orbitali molecolari di molte altre molecole, dobbiamo esaminare come gli orbitali p si combinano per dare orbitali molecolari. Gli orbitali p possono sovrapporsi in due modi: testa a testa o lateralmente. La sovrapposizione testa a testa degli orbitali atomici p produce un orbitale molecolare di legame e antibonding, in cui la densità elettronica è centrata lungo l’asse internucleare, rendendoli σ orbitali (Figura 9.22 “Sovrapposizione testa a testa degli orbitali p”).
La sovrapposizione laterale dei restanti quattro orbitali atomici p può verificarsi lungo gli altri due assi, generando quattro orbitali molecolari π con densità elettronica su lati opposti dell’asse internucleare (Figura 9.23 “Sovrapposizione laterale degli orbitali p”).
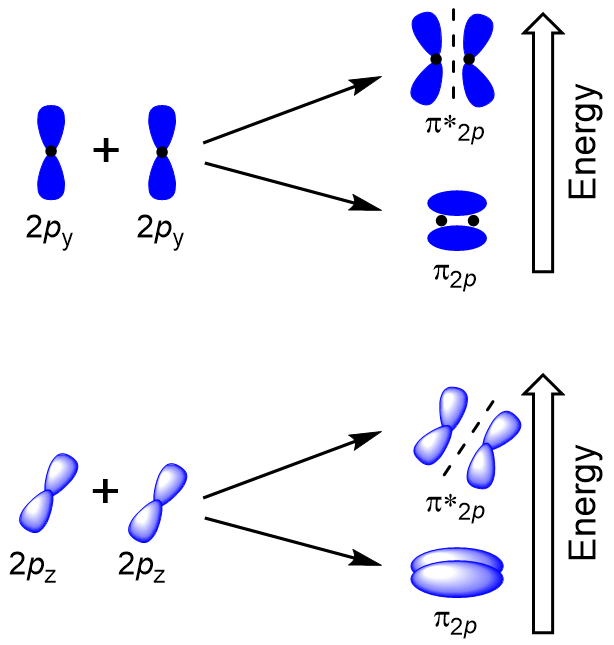
Il testa a testa si sovrappongono dando σ orbitali molecolari si traduce in una maggiore sovrapposizione, rendendo la sua orbitale molecolare di legame più stabile e più bassa energia, mentre la s* antibonding è meno stabile e ha la più alta energia (Figura 9.24 “orbitale Molecolare di energia diagramma per biatomica omonucleare molecole fatta di atomi di numero atomico 8-10”). La sovrapposizione laterale fornisce quattro orbitali molecolari π, due orbitali molecolari a legame degenerato a energia inferiore e due orbitali antibonding a energia superiore.,
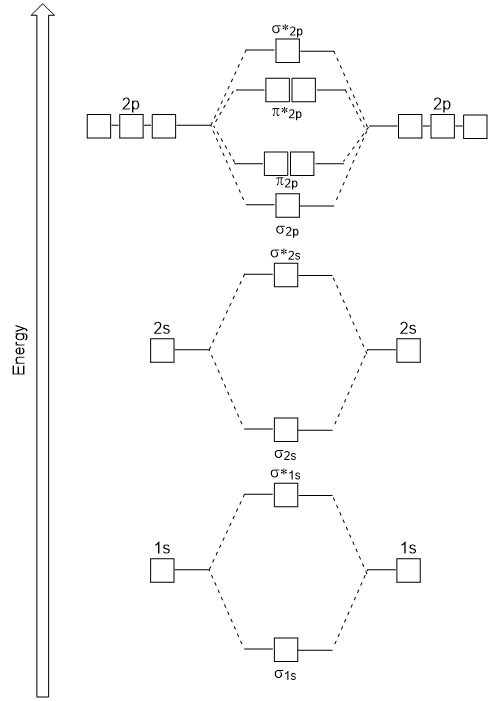
Il diagramma di energia che abbiamo appena generato si adatta sperimentalmente con O2, F2, e Ne2, ma non si adatta per B2, C2, e N2. In quest’ultimo, molecole biatomiche omonucleari (B2, C2 e N2), le interazioni avvengono tra gli orbitali atomici 2s e 2p che sono abbastanza forti da scambiare l’ordine degli orbitali molecolari σ2p e n2p (Figura 9.25).,
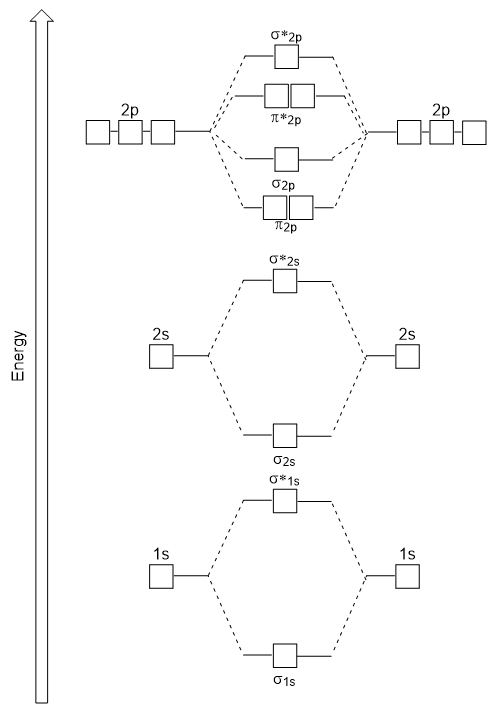
Molecole biatomiche eteronucleari
Nelle molecole biatomiche eteronucleari, dove due molecole diverse sono legate, i livelli di energia degli orbitali atomici dei singoli atomi possono differire. Tuttavia, il diagramma orbitale molecolare che vediamo in Figura 9.,25 (“Molecular orbital energy diagram for homonuclear biatomic molecules made from atoms of atomic number 5-7”) può essere utilizzato per stimare la configurazione elettronica e l’ordine di legame.
Orbitali molecolari di frontiera
Possiamo concentrarci ulteriormente su due tipi molto importanti di orbitali molecolari: l’orbitale molecolare occupato più alto (HOMO) e l’orbitale molecolare non occupato più basso (LUMO), noti anche collettivamente come orbitali molecolari di frontiera (Figura 9.26 “Orbitali molecolari di frontiera HOMO e LUMO”)., Come implicano i loro nomi, l’HOMO è l’orbitale molecolare che ha la più alta energia e contiene elettroni, mentre il LUMO è l’orbitale molecolare di energia più bassa che non contiene elettroni.
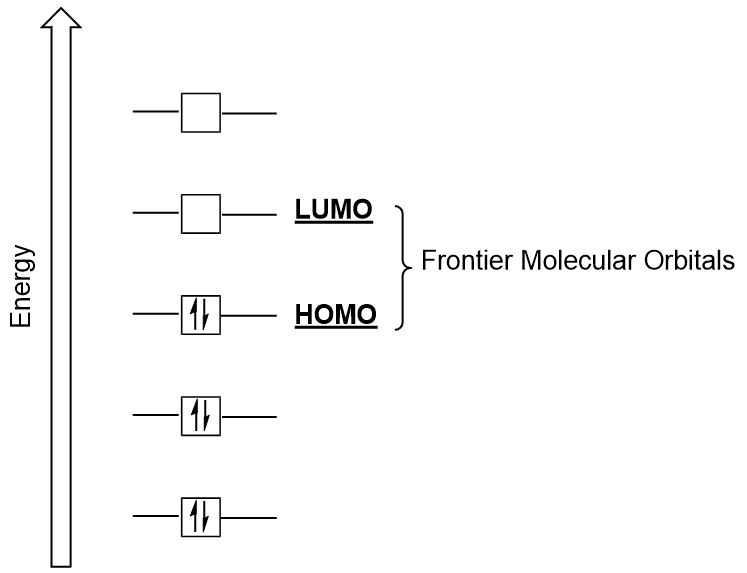
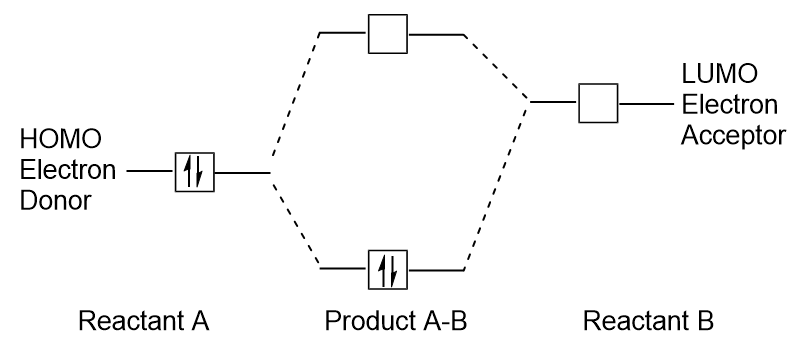
Quando le molecole assorbono energia, è tipico per un HOMO elettrone usare questa energia per passare dall’orbitale OMO a terra all’orbitale dello stato eccitato LUMO., Questo tipo di transizione può essere osservato in esperimenti di spettroscopia di radiazione ultravioletta-visibile (UV-Vis). Inoltre, in molte reazioni chimiche, una molecola reagente può donare elettroni HOMO al LUMO di un altro reagente (Figura 9.27 “Formazione di un nuovo orbitale molecolare di legame combinando HOMO reagente e LUMO”). Pertanto, la comprensione dei livelli di energia orbitale molecolare di frontiera può fornire ai chimici una grande quantità di informazioni nelle aree della spettroscopia molecolare e della reattività.
Key Takeaways
- Gli orbitali atomici possono combinarsi per creare orbitali molecolari di legame e antibonding.
- Gli orbitali di legame hanno un’energia inferiore rispetto agli orbitali antibonding.
- Gli orbitali molecolari sono riempiti usando principi simili agli orbitali atomici.
- L’ordine di legame può essere utilizzato per valutare la forza di legame.
- Gli orbitali molecolari di frontiera sono di particolare importanza nella spettroscopia molecolare e nella reattività.