Tanulási Célok
- értsék a molekuláris orbitális elmélet.
- Ismerje meg a kötvényrendelések kiszámítását.
- Tanulj meg rajzolni a molekuláris orbitális elektron konfigurációs energiagazdálkodási diagramokat.
Valence bond elmélet képes megmagyarázni sok szempontból kötés, de nem minden. Ennek az elméletnek a kiegészítéséhez egy másik úgynevezett molekuláris orbitális (MO) elméletet használunk., A molekuláris orbitális elmélet kifinomultabb modell a kémiai kötés természetének megértéséhez.
A Mo elmélet az atomi pályák új szintre átfedésének gondolatát veszi fel, ahol új molekuláris pályákat generálnak az atomi pályák (lcao) lineáris kombinációjának nevezett matematikai eljárással.
A molekuláris pályák sok hasonlóságot mutatnak az atomi pályákkal:
– a legalacsonyabb energiától a legmagasabb energiáig (Aufbau elv) töltődnek be.
– legfeljebb két elektront tarthatnak szemközti spin / orbitális (Pauli kizárási elv).,
az atomi és a molekuláris pályák közötti fő különbség az, hogy az atomi pályák egy adott atomhoz kapcsolódó térben elektronsűrűséget képviselnek. A molekuláris pályák az egész molekulához kapcsolódnak, ami azt jelenti, hogy az elektronsűrűség több atom felett delokalizálódik (szétterül).
A Hidrogénmolekula molekuláris pályái
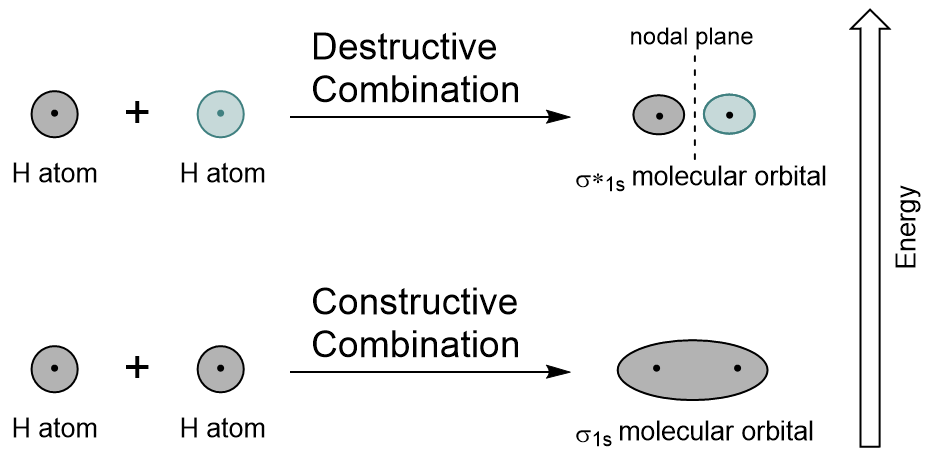
Az egyes hidrogénatom 1s pályáit az LCAO segítségével ötvözve két molekuláris orbitál keletkezik σ1s (ejtsd: sigma one s) és σ*1s (ejtsd: sigma star One S).,
a σ1s orbitális egy konstruktív kombinációval (vagy interferenciával) jön létre, ahol a két atomi orbitális hullámfunkció megerősíti (hozzáadja) egymást. Ez a két molekuláris pálya alacsonyabb energiája, amelyet a kötés molekuláris orbitálisnak neveznek. A 9.19.ábrán látható “hidrogén molekuláris orbitális kombinációs diagram”, hogy ennek az orbitának az elektronsűrűsége a két mag között koncentrálódik. Ezeket az elektronokat mindkét mag stabilizálja, és kovalens kötéssel együtt tartják az atomokat.,
a σ * 1s orbitális egy destruktív kombináció (vagy interferencia) által keletkezik, ahol a két atompálya hullámfunkciói megszakítják egymást. Ez a fajta kombináció nulla elektronsűrűséget eredményez a két mag között, csomós síkként (vagy csomópontként) ismert. Ez a nulla elektronsűrűségű csomópont destabilizálódik a kötés felé, így nagyobb energiát eredményez, majd ezt a típusú orbitát antibonding molekuláris orbitának nevezik (amelyet az orbitális név csillaga jelöl).
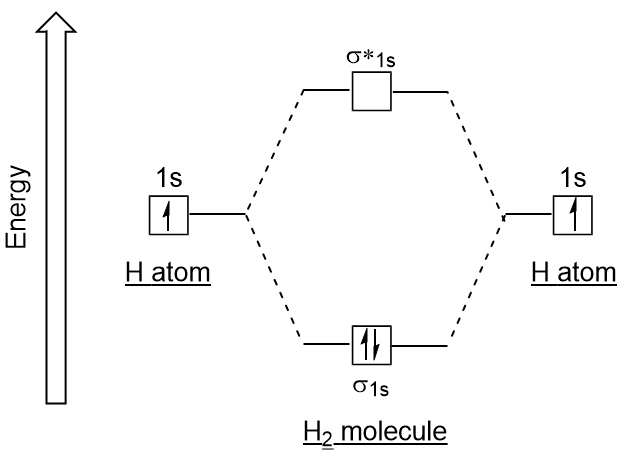
Az atomi pályákhoz hasonlóan írhatunk elektronkonfigurációs energiagazdálkodási diagramokat molekuláris pályákra (9.20. Figyeljük meg, hogy az egyes atomok atomi pályái mindkét oldalon vannak írva, az újonnan kialakult molekuláris pályákat pedig a diagram közepére írják., A kötés molekuláris pályája tele van, energiája viszonylag alacsonyabb, mint a hozzájáruló atomi pályáknál, alátámasztva azt a tényt, hogy a hidrogénmolekulák (H2) stabilabbak, mint a magányos hidrogénatomok.
Bond Order
most láttuk, hogy a kötés molekuláris pályája alacsonyabb energia, és elősegíti a kovalens kötés kialakulását, míg az antibonding molekuláris orbitális nagyobb energia, nulla elektronsűrűségű csomóponttal az atomok között, amelyek destabilizálják a kovalens kötés kialakulását. A kovalens kötés erősségét a kötési sorrend meghatározásával értékelhetjük.
Bond order = 1/2 (#elektronok kötés mos – # elektronok antibonding MOs)
Bond-rend értékek lehetnek egész számok, frakciók, vagy nulla., Ezek az értékek megfelelnek a valence bond modellnek, tehát az 1-es kötési sorrend egyenlő egy kötéssel, a 2-es pedig kettős kötéssel. A nulla érték azt jelenti, hogy nincs kötés, az atomok külön léteznek.
11. példa
határozza meg a hidrogénmolekula kötési sorrendjét.
Bond order = 1/2 (#of electrons in bonding mos – # of electrons in antibonding MOs)
Bond order = 1/2 (2 – 0) = 1
ezért a hidrogénmolekulában egyetlen kötés van.,
LI2 molekuláris pályái
a molekulák molekuláris pályáinak generálása összetettebb, mint a hidrogén az lcao módszerrel, néhány további iránymutatást igényel:
– a generált MOs száma megegyezik az atomi pályák számával.
– A kombinált atompályáknak hasonló energiaszintnek kell lenniük.
– az atomi orbitális kombináció hatékonysága az orbitális átfedés mennyiségétől függ. Fokozott átfedés csökkenti az energia a kötés molekuláris orbitális tovább, és növeli az energiát az antibonding molekuláris orbitális.,
kövessük ezeket az irányelveket, és hozzunk létre egy molekuláris orbitális elektronkonfigurációs diagramot a Li2-hez (9.21. ábra “molekuláris orbitális elektron konfigurációs energiája diagram dilithiumhoz”):
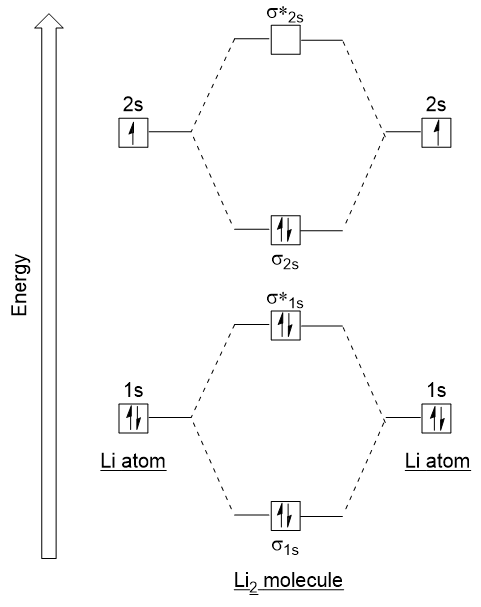
figyeljük meg, hogy az 1s atomi pályákat, mint korábban a H2 példában, összekapcsoltuk olyan kötés és blokkolásgátló molekuláris pályákkal, amelyeket mindkét Atom 1S elektronja teljesen megtölt., Hasonlóképpen a 2s atomi orbitals is kombinálódik, így a kötés orbitális és antibonding orbitális, amelyek tele vannak a fennmaradó valence elektronok kezdve alulról felfelé. Az összekapcsolódó atompályák hasonló energiaszintűek; az 1s orbitális nem kombinálódik a 2s orbitális egyikével.
a kötési sorrend meghatározható ahhoz, hogy ez a molekula:
kötési sorrend legyen = 1/2 (4 – 2) = 1
ezért a Li2-nek egyetlen kötése lenne.,
molekuláris pályák a P atomi pályákból
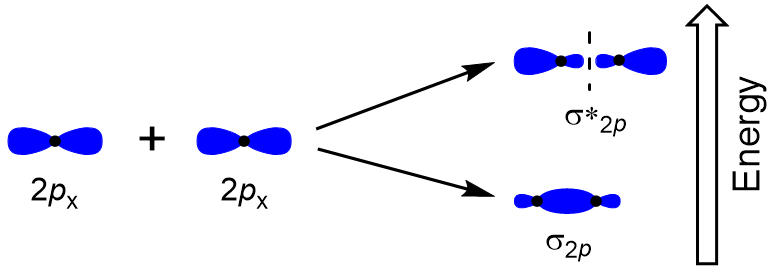
sok más molekula molekuláris pályáinak meghatározásához meg kell vizsgálnunk,hogy a P pályák hogyan kombinálódnak a molekuláris pályák megadásához. A P pályák két módon átfedhetnek: fej-fej vagy oldalirányban. A P atomic orbitals fej-fej átfedése egy kötési és blokkolásgátló molekulapályát eredményez, ahol az elektron sűrűsége az internukleáris tengely mentén helyezkedik el, így σ orbitálok (9.22. ábra “A P orbitálok fej-fej átfedése”).
a fennmaradó négy P atomi pálya oldalirányú átfedése a másik két tengely mentén fordulhat elő, négy π molekuláris orbitált generálva, amelyek elektronsűrűsége az internukleáris tengely ellentétes oldalán van (9.23.
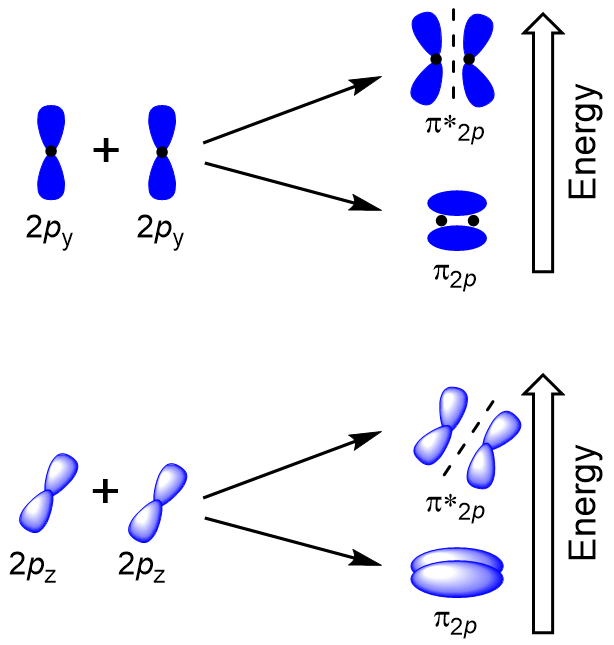
A head-to-head átfedés adott σ molekuláris elektronpályák eredmények nagyobb az átfedés, így a molekuláris kötés orbitális a legtöbb stabil, legalacsonyabb energia, míg a σ* antibonding legkevésbé stabil, a legmagasabb energia (Ábra 9.24 “Molekuláris orbitális energia diagram homonuclear kétatomos molekulák készült atom rendszáma 8-10”). Az oldalirányú átfedés négy π molekuláris orbitált, két alacsonyabb energiájú degenerált kötésű molekuláris orbitált és két nagyobb energiájú antibonding orbitált ad.,
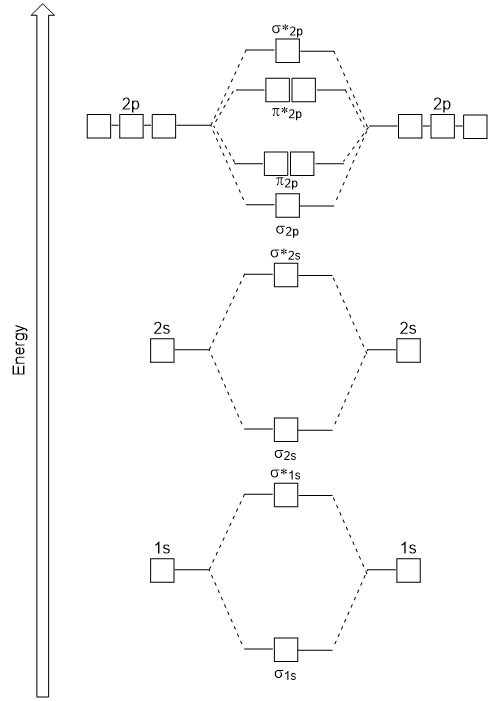
Az energia diagram csak a generált illik kísérletileg a O2, F2, valamint Ne2, de nem illik a B2, C2, valamint az N2. Ez utóbbiban homonukleáris diatomikus molekulák (B2, C2 és N2) kölcsönhatások zajlanak a 2s és 2p atomi pályák között, amelyek elég erősek ahhoz, hogy a σ2p és n2p molekuláris pályák sorrendjét megváltoztassák (9.25 ábra).,
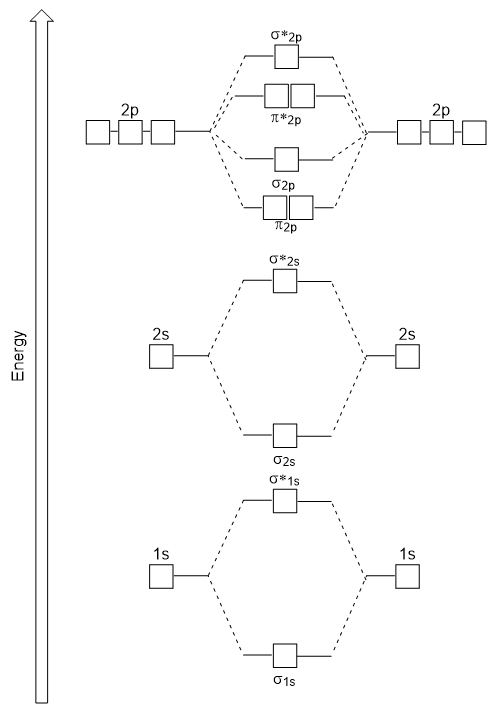
Heteronukleáris Diatomikus molekulák
heteronukleáris diatomikus molekulákban, ahol két különböző molekulát kötnek össze, az egyes atomok atompályáinak energiaszintje eltérhet. A 9.ábrán látható molekuláris orbitális diagram azonban.,25 (“Molecular orbital energy diagram for homonuclear diatomic molecules made from atomic number 5-7”) can be used to estimate the electron configuration and bond order.
Határ Molekuláris Elektronpályák
törődjünk további két nagyon fontos típusú molekuláris elektronpályák: a legmagasabb foglalt molekuláris orbitális (HOMO), a legalacsonyabb üres molekuláris orbitális (LUMO) is említett együttesen, mint a határ molekuláris elektronpályák (Ábra 9.26 “Határ molekuláris elektronpályák HOMO pedig LUMO”)., Ahogy nevük is sugallja, a HOMO az a molekuláris orbitális, amely a legnagyobb energiával rendelkezik, elektronokat tartalmaz, míg a LUMO a legalacsonyabb energiájú molekuláris orbitális, amely nem tartalmaz elektronokat.
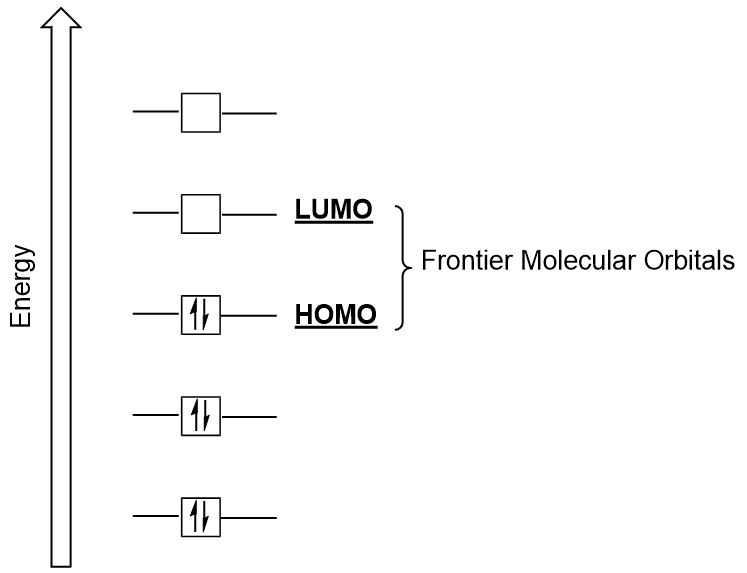
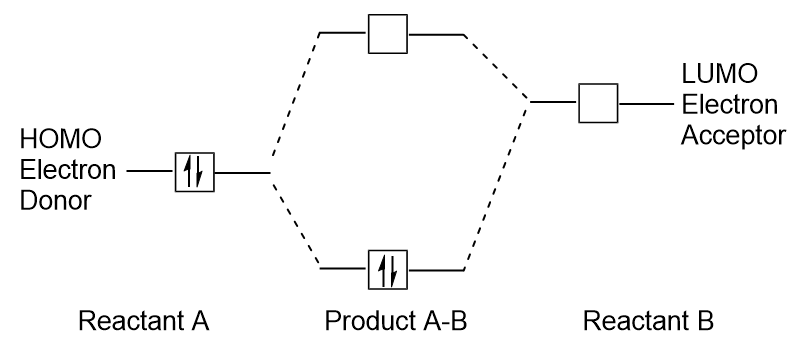
amikor a molekulák elnyelik az energiát, jellemző, hogy egy HOMO elektron ezt az energiát használja a földről való átmenethez HOMO orbitális a LUMO gerjesztett állapotú orbitális., Ez a fajta átmenet megfigyelhető ultraibolya-látható (UV-Vis) sugárzási spektroszkópiai kísérletekben. Számos kémiai reakcióban az egyik reaktáns molekula HOMO elektronokat adományozhat egy másik reaktáns LUMO-jának (9.27. ábra “új kötési molekuláris orbitális képződése a reaktáns HOMO és LUMO kombinálásával”). Ezért a határ menti molekuláris orbitális energiaszintek megértése nagy betekintést nyújthat a kémikusoknak a molekuláris spektroszkópia és a reaktivitás területén.
Key Takeaways
- az Atomic orbitals kombinálható a kötés és az antibondolás molekuláris pályáinak kialakításához.
- a kötési pályák energiája alacsonyabb, mint az antibonding orbitals.
- a molekuláris pályákat az atomi pályákhoz hasonló elvekkel töltik meg.
- a Kötésrendelés használható a kötés erősségének értékelésére.
- A Frontier molecular orbitals különösen fontos a molekuláris spektroszkópiában és a reaktivitásban.