Objectifs d’Apprentissage
- Acquérir une compréhension de la théorie des orbitales moléculaires.
- Apprenez à calculer les ordres d’obligations.
- Apprenez à dessiner des diagrammes d’énergie de configuration d’électrons orbitaux moléculaires.
La théorie des liaisons de Valence est capable d’expliquer de nombreux aspects de la liaison, mais pas tous. Pour compléter cette théorie, nous utilisons une autre théorie appelée orbitale moléculaire (MO)., La théorie des orbitales moléculaires est un modèle plus sophistiqué pour comprendre la nature de la liaison chimique.
La théorie MO porte l’idée de chevauchement d’orbitales atomiques à un nouveau niveau, où de nouvelles orbitales moléculaires sont générées à l’aide d’un processus mathématique appelé combinaison linéaire d’orbitales atomiques (LCAO).
Les orbitales moléculaires partagent de nombreuses similitudes avec les orbitales atomiques:
– Elles sont remplies de la plus basse énergie à la plus haute énergie (principe d’Aufbau).
– Ils peuvent contenir un maximum de deux électrons de spin opposé par orbitale (principe d’exclusion de Pauli).,
La différence majeure entre les orbitales atomiques et moléculaires est que les orbitales atomiques représentent la densité électronique dans l’espace associée à un atome particulier. Les orbitales moléculaires sont associées à la molécule entière, ce qui signifie que la densité électronique est délocalisée (étalée) sur plus d’un atome.
Les orbitales moléculaires de la Molécule d’hydrogène
En combinant les orbitales 1s de chaque atome d’hydrogène à l’aide de LCAO, deux orbitales moléculaires sont générées σ1s (prononcé sigma un s) et σ*1s (prononcé sigma étoile un s).,
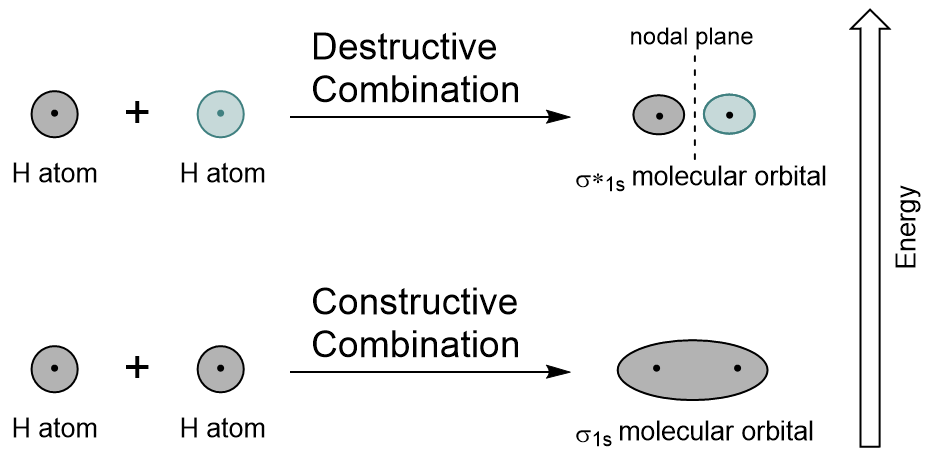
L’orbitale σ1s est générée par une combinaison constructive (ou interférence), où les deux fonctions d’onde orbitales atomiques se renforcent (s’ajoutent) l’une à l’autre. C’est l’énergie inférieure des deux orbitales moléculaires et est connue sous le nom d’orbitale moléculaire de liaison. Notez à la Figure 9.19 « Diagramme de combinaison orbitale moléculaire de l’hydrogène » que la densité électronique de cette orbitale est concentrée entre les deux noyaux. Ces électrons sont stabilisés par des attractions aux deux noyaux, et ils maintiennent les atomes ensemble avec une liaison covalente.,
L’orbitale σ*1s est générée par une combinaison destructive (ou interférence), où les fonctions d’onde des deux orbitales atomiques s’annulent. Ce type de combinaison se traduit par une zone de densité électronique nulle entre les deux noyaux, connue sous le nom de plan nodal (ou nœud). Ce nœud de densité électronique nulle est déstabilisant vers la liaison, ce qui en fait une énergie plus élevée, et par la suite ce type d’orbitale est connu comme une orbitale moléculaire antibondante (désignée par l’astérisque dans le nom orbital).
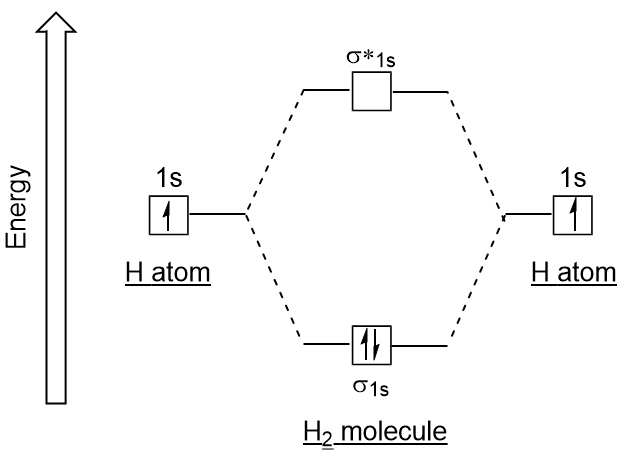
Similaire aux orbitales atomiques, nous pouvons écrire des diagrammes d’énergie de configuration électronique pour les orbitales moléculaires (Figure 9.20 « Diagramme d’énergie de configuration électronique orbitale moléculaire hydrogène”). Notez que les orbitales atomiques de chaque atome sont écrites de chaque côté, et les orbitales moléculaires nouvellement formées sont écrites au centre du diagramme., L’orbitale moléculaire de liaison est remplie et est relativement plus faible en énergie que les orbitales atomiques contributives, ce qui soutient le fait que les molécules d’hydrogène (H2) sont plus stables que les atomes d’hydrogène isolés.
Ordre de liaison
Nous venons de voir que l’orbitale moléculaire de liaison est de plus faible énergie et favorise la formation d’une liaison covalente, tandis que l’orbitale moléculaire antibondante est de plus grande énergie avec un nœud de densité électronique nulle entre les atomes qui déstabilise la formation d’une liaison covalente. Nous pouvons évaluer la force d’une liaison covalente en déterminant son ordre de liaison.
Bond order = 1/2 (# d’électrons dans bonding MOs – # d’électrons dans antibonding MOs)
Bond-order les valeurs peuvent être des nombres entiers, des fractions ou zéro., Ces valeurs correspondent au modèle de liaison de valence, donc un ordre de liaison de 1 est égal à une liaison simple et 2 est égal à une liaison double. Une valeur de zéro signifie qu’il n’y a pas de liaison présente et que les atomes existent séparément.
Exemple 11
Déterminer les obligations de l’ordre de la molécule d’hydrogène.
Solution
Ordre de liaison = 1/2 (nombre d’électrons dans la liaison MOs – Nombre d’électrons dans la liaison MOS)
Ordre de liaison = 1/2 (2 – 0) = 1
Il y a donc une seule liaison dans la molécule d’hydrogène.,
Orbitales moléculaires de Li2
Générer des orbitales moléculaires de molécules plus complexes que l’hydrogène en utilisant la méthode LCAO nécessite de suivre quelques directives supplémentaires:
– Le nombre de MOs générés est égal au nombre d’orbitales atomiques combinées.
– Les orbitales atomiques combinées devraient avoir des niveaux d’énergie similaires.
– L’efficacité de la combinaison orbitale atomique dépend de la quantité de chevauchement orbital. Un chevauchement accru réduit davantage l’énergie de l’orbitale moléculaire de liaison et augmente l’énergie de l’orbitale moléculaire antibondante.,
Suivons ces directives et générons un diagramme de configuration d’électrons orbitaux moléculaires pour Li2 (Figure 9.21 « Diagramme d’énergie de configuration d’électrons orbitaux moléculaires pour dilithium”):
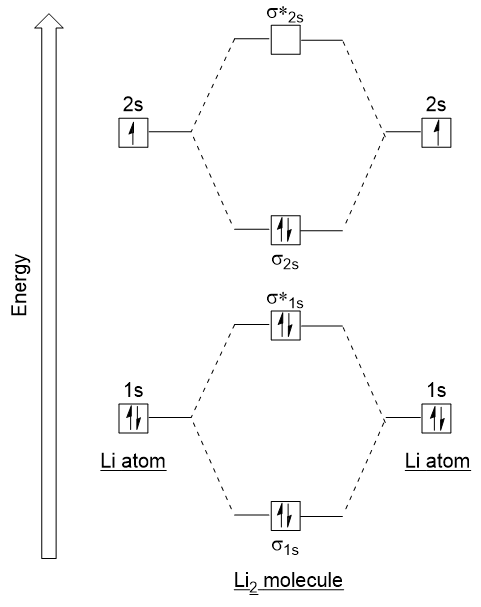
Notez que nous avons combiné les orbitales atomiques 1s, comme précédemment dans l’exemple H2, pour générer des orbitales moléculaires de liaison et d’antibondage qui sont complètement remplies par les électrons 1s des deux atomes., De même, les orbitales atomiques 2s se combinent, donnant une orbitale de liaison et une orbitale antibondante, qui sont remplies des électrons de valence restants à partir du bas vers le haut. Les orbitales atomiques qui se combinent sont de niveaux d’énergie similaires; une orbitale 1s ne se combine pas avec l’une des orbitales 2s.
L’ordre de liaison peut être déterminé pour que cette molécule soit:
Ordre de liaison = 1/2 (4 – 2) = 1
Li2 aurait donc une seule liaison.,
Orbitales Moléculaires à partir de p Orbitales Atomiques
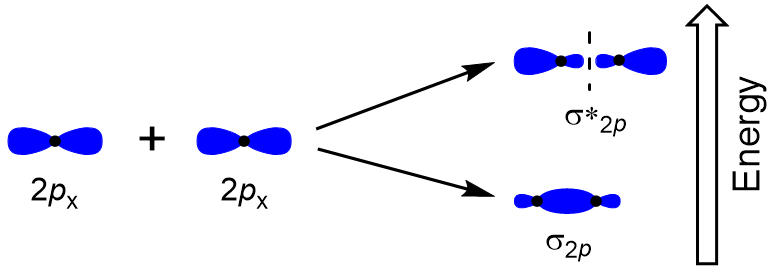
Pour déterminer les orbitales moléculaires de nombreuses autres molécules, nous avons besoin d’examiner comment les orbitales p combinent pour donner des orbitales moléculaires. Les orbitales p peuvent se chevaucher de deux manières: face à face ou latéralement. Le chevauchement tête-à-tête des orbitales atomiques p entraîne une orbitale moléculaire de liaison et d’antibondage, où la densité électronique est centrée le long de l’axe internucléaire, ce qui en fait des orbitales σ (Figure 9.22 « Chevauchement tête-à-tête des orbitales p”).
Un chevauchement latéral des quatre orbitales atomiques p restantes peut se produire le long des deux autres axes, générant quatre orbitales moléculaires π ayant une densité électronique sur les côtés opposés de l’axe internucléaire (Figure 9.23”Chevauchement latéral des orbitales p »).
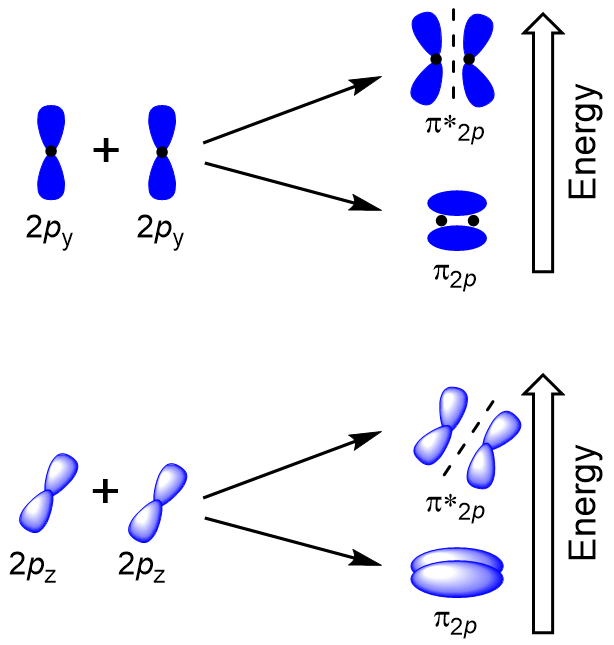
Le chevauchement tête-à-tête donnant des orbitales moléculaires σ entraîne un chevauchement plus important, faisant de son orbitale moléculaire de liaison l’énergie la plus stable et la plus faible, tandis que l’antibondage σ* est le moins stable et a l’énergie la plus élevée (Figure 9.24″Diagramme Le chevauchement latéral donne quatre orbitales moléculaires π, deux orbitales moléculaires à liaison dégénérée de plus faible énergie et deux orbitales antibondantes de plus haute énergie.,
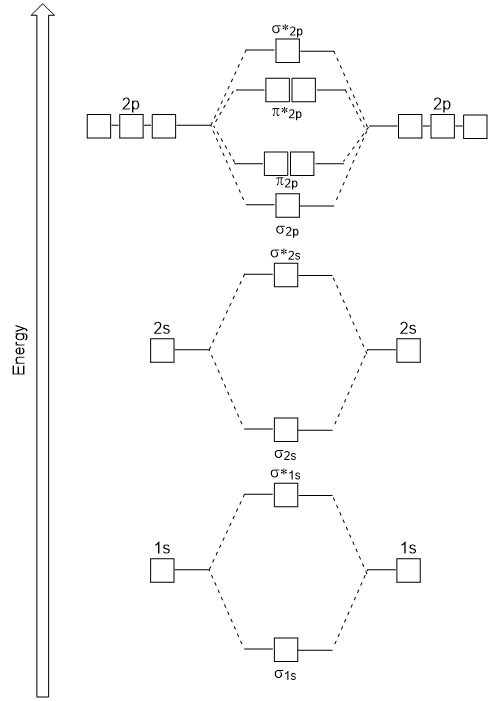
Le diagramme d’énergie que nous venons de générer correspond expérimentalement à O2, F2 et Ne2, mais ne convient pas pour B2, C2 et N2. Dans ces dernières molécules diatomiques homonucléaires (B2, C2 et N2), des interactions ont lieu entre les orbitales atomiques 2s et 2p qui sont suffisamment fortes pour permuter l’ordre des orbitales moléculaires σ2p et n2p (Figure 9.25).,
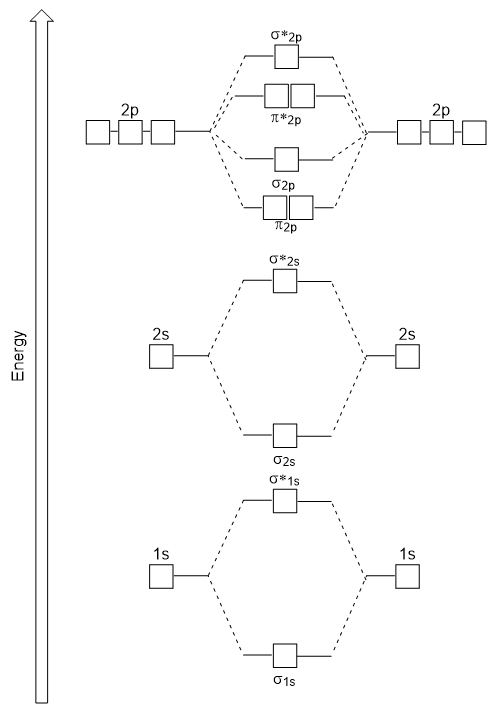
Molécules Diatomiques Hétéronucléaires
Dans les molécules diatomiques hétéronucléaires, où deux molécules sont collées, les niveaux d’énergie des atomes individuels’ orbitales atomiques peuvent différer. Cependant, le diagramme orbital moléculaire que nous voyons dans la figure 9.,25 (« Diagramme d’énergie orbitale moléculaire pour les molécules diatomiques homonucléaires fabriquées à partir d’atomes de numéro atomique 5-7 ») peut être utilisé pour estimer la configuration électronique et l’ordre de liaison.
Orbitales moléculaires frontières
Nous pouvons nous concentrer davantage sur deux types très importants d’orbitales moléculaires: l’orbitale moléculaire occupée la plus élevée (HOMO) et l’orbitale moléculaire inoccupée la plus basse (LUMO), également appelées collectivement orbitales moléculaires frontières (Figure 9.26 « orbitales moléculaires frontières HOMO et LUMO”)., Comme leurs noms l’impliquent, l’HOMO est l’orbitale moléculaire qui a la plus haute énergie et contient des électrons, tandis que le LUMO est l’orbitale moléculaire la plus basse énergie qui ne contient pas d’électrons.
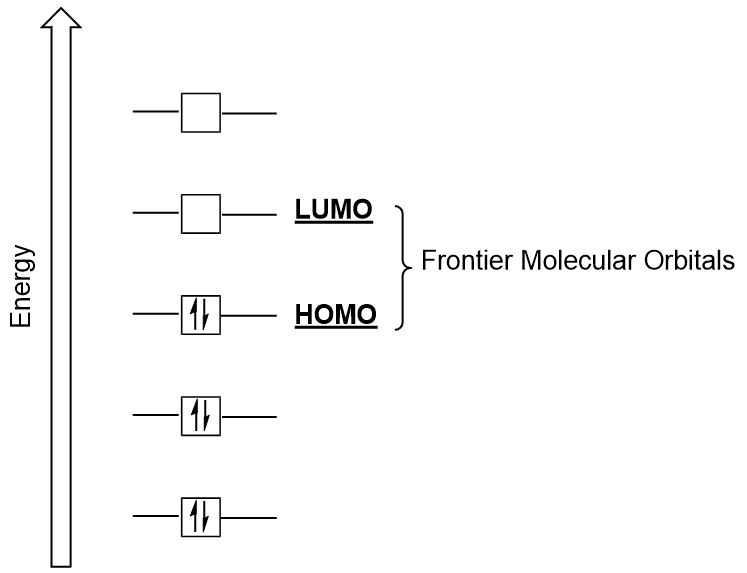
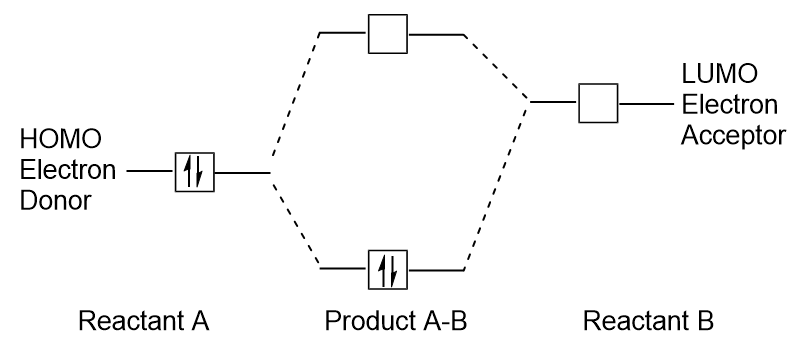
Lorsque les molécules absorbent de l’énergie, il est typique pour un électron HOMO d’utiliser cette énergie pour passer de l’orbitale HOMO terrestre à l’orbitale à état excité LUMO., Ce type de transition peut être observé dans des expériences de spectroscopie de rayonnement ultraviolet-visible (UV-Vis). De plus, dans de nombreuses réactions chimiques, une molécule réactive peut donner des électrons HOMO au LUMO d’un autre réactif (Figure 9.27 « Formation d’une nouvelle orbitale moléculaire de liaison en combinant le réactif HOMO et le LUMO”). Par conséquent, la compréhension des niveaux d’énergie orbitale moléculaire frontière peut fournir aux chimistes beaucoup d’informations dans les domaines de la spectroscopie moléculaire et de la réactivité.
Principaux points à retenir
- Les orbitales atomiques peuvent se combiner pour créer des orbitales moléculaires de liaison et d’antibondage.
- Les orbitales de liaison sont plus faibles en énergie que les orbitales antibondantes.
- Les orbitales moléculaires sont remplies en utilisant des principes similaires aux orbitales atomiques.
- L’ordre de liaison peut être utilisé pour évaluer la force de liaison.
- Les orbitales moléculaires frontières sont particulièrement importantes en spectroscopie moléculaire et en réactivité.