Oppimisen Tavoitteet
- ymmärtämään molecular orbital theory.
- Opettele laskemaan bond-tilauksia.
- opettele piirtämään molekyyliorbitaalien elektronikonfiguraation energiakaavioita.
Valenssisidosteoria pystyy selittämään monia sidoksen piirteitä, mutta ei kaikkia. Tämän teorian täydentämiseksi käytämme toista molekyyliorbitaaliteoriaa (Mo)., Molekyyliorbitaaliteoria on kehittyneempi malli kemiallisen sidoksen luonteen ymmärtämiseksi.
MO teoria vie ajatusta atomic orbitaalit päällekkäisiä uudelle tasolle, jossa uusi molekyyli orbitaalit muodostetaan käyttäen matemaattista prosessia kutsutaan linear combination of atomic orbitals (LCAO).
Molekyyli orbitaalit jakaa monia yhtäläisyyksiä atomic orbitaalit:
– He ovat täynnä pienimmästä energiaa eniten energiaa (Aufbau-periaate).
– He voivat pitää enintään kaksi elektronia vastapäätä spin per orbital (Paulin kieltosääntö).,
suurin ero atomi-ja molekyyli orbitaalit on, että atomi orbitaalit muodostavat elektroni tiheys avaruudessa liittyy tiettyyn atom. Molekyyli orbitaalit ovat liittyvät koko molekyylin, eli electron tiheys on delokalisoituneita (levittää) yli enemmän kuin yksi atomi.
Molekyyli Orbitaalit Vety-Molekyylin
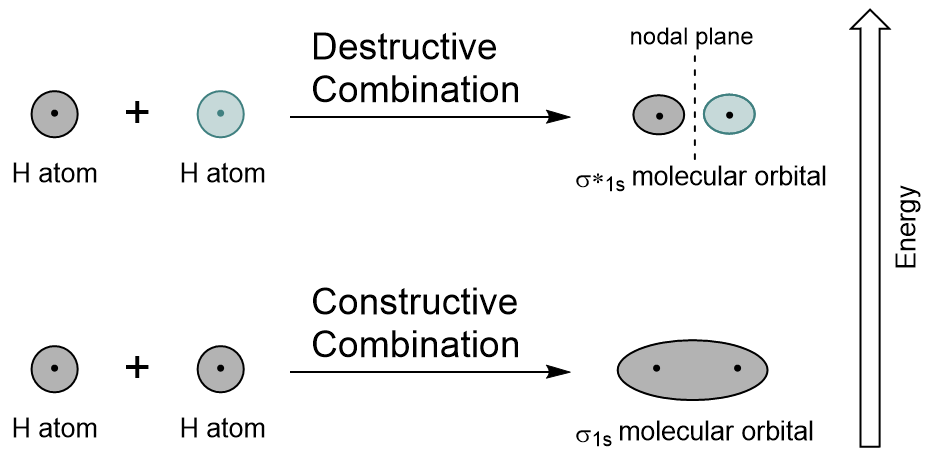
Yhdistämällä 1s-orbitaalit jokainen vetyatomi käyttämällä LCAO, kaksi molekyyli orbitaalit muodostetaan σ1s (lausutaan sigma one s) ja σ*1s (lausutaan sigma star one s).,
σ1s kiertoradan syntyy rakentavaa yhdistelmä (tai häiriö), jossa kaksi atomic orbitaalit aalto toimintoja, vahvistaa (lisää) toisiaan. Tämä on kahden molekyyliorbitaalin alempi Energia ja tunnetaan sidosaineena molekyyliorbitaalina. Ilmoituksen Kuva 9.19 ”Vedyn molekyyli silmäkuopan yhdistelmä kaavio”, että elektroni tiheys tämän orbital on keskittynyt välillä kaksi ydintä. Näitä elektroneja stabiloivat molempien ytimien vetovoima, ja ne pitävät atomit koossa kovalenttisen sidoksen kanssa.,
σ*1s silmäkuopan syntyy tuhoisa yhdistelmä (tai häiriö), jossa aalto toiminnot kaksi atomic orbitaalit kumoavat toisensa. Tämän tyyppinen yhdistelmä johtaa siihen, että ala on nolla electron tiheys välillä kaksi ydintä, joka tunnetaan solmukohtien kone (tai solmu). Tämä solmu on nolla electron tiheys on epävakautta kohti bond, jolloin se on enemmän energiaa, ja sen jälkeen tämä tyyppi kiertoradan tunnetaan antibonding molekyyli silmäkuopan (merkitty tähdellä kiertoradan nimi).
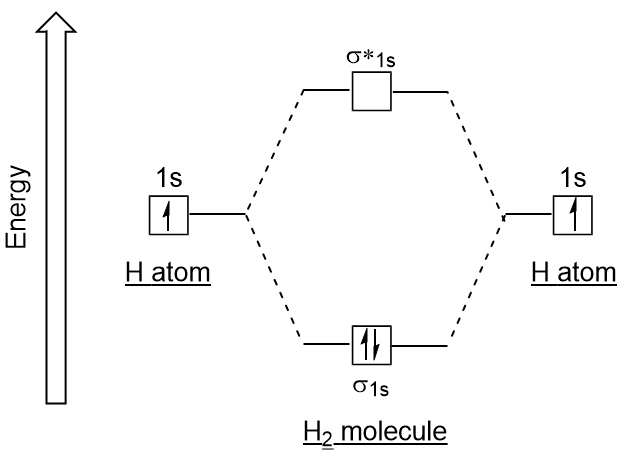
Samanlainen atomic orbitaalit, voimme kirjoittaa elektronin kokoonpano energia-kaaviot, molekyyli orbitaalit (Kuva 9.20 ”Vedyn molekyyli silmäkuopan electron kokoonpano energia-kaavio”). Huomaa, että atomien orbitaalien jokainen atomi on kirjoitettu kummallakin puolella, ja vastaperustetun molekyyli orbitaalit ovat kirjoitettu keskuksen kaavio., Liimaus molecular orbital on täynnä ja on suhteellisen pienempi energia kuin edistää atomic orbitaalit, tukee se, että vety molekyylien (H2) ovat vakaampia kuin yksinäinen vetyatomit.
Bond Order
Olemme juuri nähneet, että liimaus molecular orbital on alempi energiaa ja edistää muodostumista kovalenttinen sidos, kun antibonding molecular orbital on korkeampi energian solmu on nolla electron tiheys välillä atomit, jotka horjuttaa muodostuu kovalenttinen sidos. Voimme arvioida kovalenttisen sidoksen vahvuutta määrittämällä sen sidosjärjestyksen.
Bond order = 1/2 (# elektronien liimaus MOs – # elektronien antibonding MOs)
Bond-jotta arvot voivat olla kokonaislukuja, jakeet, tai nolla., Nämä arvot vastaavat valence bond malli, joten bond järjestyksessä 1 on yhtä suuri kuin yhden bond, ja 2 on yhtä suuri kuin kaksinkertainen sidos. Nollan arvo tarkoittaa sitä, että sidosta ei ole olemassa, ja atomit ovat olemassa erikseen.
Esimerkki 11
Päättää joukkovelkakirjalainan, jotta vety-molekyylin.
Ratkaisu
Bond order = 1/2 (# elektronien liimaus MOs – # elektronien antibonding MOs)
Bond jotta = 1/2 (2 – 0) = 1
Siten on yksi bond-vety-molekyylin.,
Molekyylien Orbitaalien Li2
Tuottaa molekyyli orbitaalit molekyylien monimutkaisempi kuin vetyä käyttämällä LCAO menetelmä vaatii seuraavat muutamia muita ohjeita:
– määrä MOs syntyy on yhtä suuri määrä atomic orbitaalit yhdistettynä.
– yhdistettyjen atomiorbitaalien tulisi olla energiatasoltaan samanlaisia.
– atomiorbitaaliyhdistelmän tehokkuus riippuu orbitaalien päällekkäisyyksien määrästä. Lisääntynyt päällekkäisyys alentaa energia liimaus molecular orbital edelleen, ja nostaa energian antibonding molecular orbital.,
nyt seuraa näitä ohjeita ja luoda molekyyli silmäkuopan electron kokoonpano kaavio Li2 (Kuva 9.21 ”Molecular orbital electron kokoonpano energiaa kaavio dilitium”):
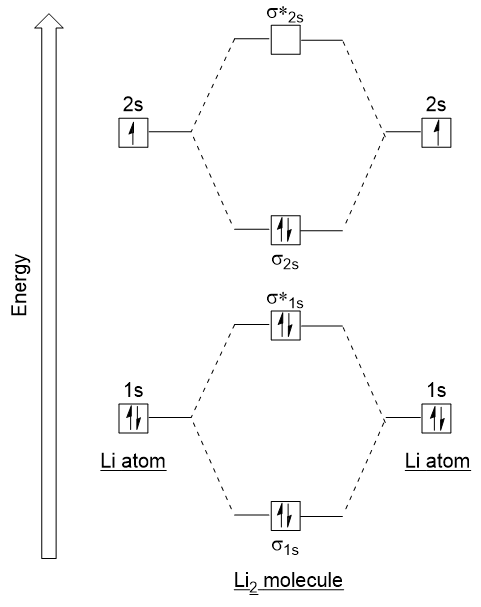
Huomaa, että meillä on yhdistetty 1s atomic orbitaalit, kun ennen H2 esimerkki, tuottaa liimaus ja antibonding molekyyli orbitaalit, jotka ovat täysin täynnä sekä atomien’ 1s elektronit., Samoin 2s atomic orbitaalit yhdistyvät, jolloin liimaus kiertoradan ja antibonding orbital, jotka ovat täynnä jäljellä valence elektronit alkaa alhaalta ylöspäin. Yhdistyneet atomiorbitaalit ovat energiatasoltaan samanlaisia; 1s-orbitaali ei yhdisty yhteen 2s-orbitaalien kanssa.
bond, jotta voidaan määrittää tämän molekyylin olla:
Bond jotta = 1/2 (4 – 2) = 1
näin Ollen Li2 olisi yksi bond.,
Molekyyli Orbitaalit p Atomi Orbitaalit
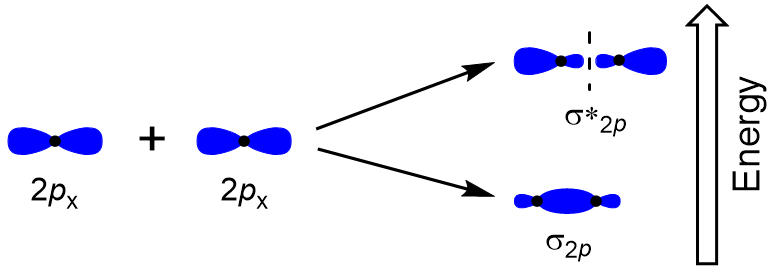
määrittää molekyyli orbitaalit monet muut molekyylit, meidän täytyy tutkia, miten p-orbitaalit yhdistyvät antaa molekyyli orbitaalit. P-orbitaalit voivat limittyä kahdella tavalla: päästä päähän tai sivusuunnassa. Head-to-Head päällekkäisyys p atomi orbitaalit johtaa liimaus ja antibonding molecular orbital, jossa elektroni tiheys on keskittynyt pitkin internuclear akselilla, jolloin ne on σ-orbitaalit (Kuva 9.22 ”Head-to-Head päällekkäin p-orbitaalit”).
Sivuttain päällekkäin loput neljä p atomi orbitaalit voi esiintyä pitkin kaksi muuta akselia, tuottaa neljä d molekyyli orbitaalit, joilla electron tiheys vastakkaisilla puolilla internuclear akselilla (Kuva 9.23 ”Sivuttain päällekkäin p-orbitaalit”).
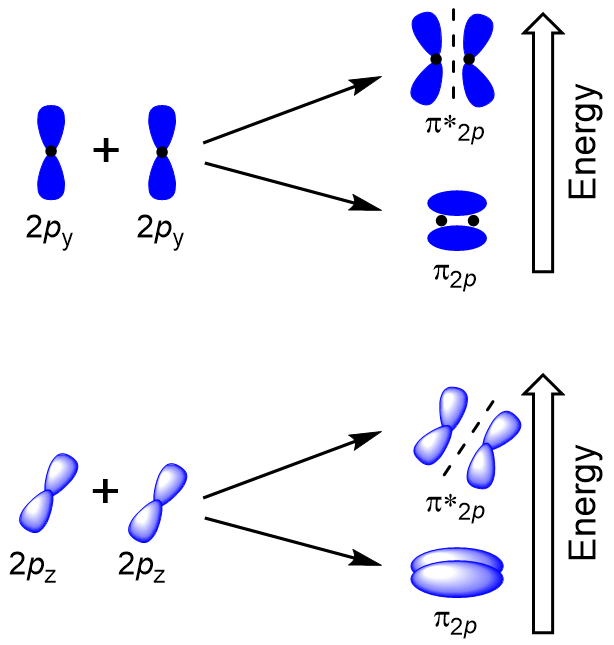
head-to-head päällekkäin jolloin σ molekyyli orbitaalit tuloksia enemmän päällekkäin, joten sen liimaus molecular orbital vakain ja vähiten energiaa, kun taas σ* antibonding on ainakin vakaa ja on korkein energia (Kuva 9.24 ”Molecular orbital energia-kaavio homonuclear kaksiatomisen molekyylien valmistettu atomien järjestysluku 8-10”). Sivuttain päällekkäin antaa neljä d molekyyli orbitaalit, kaksi alemman energian rappeutua-liimaus molekyyli orbitaalit, ja kaksi korkea-energia antibonding orbitaalit.,
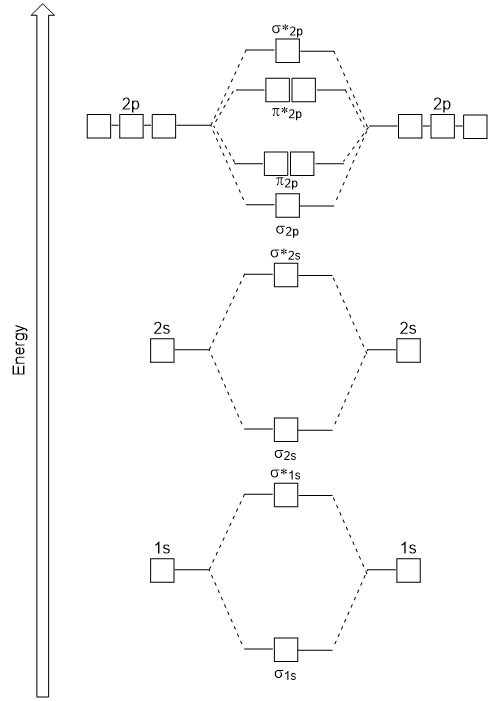
energiaa kaavio meillä on vain syntyy sopii kokeellisesti O2 -, F2 -, ja Ne2, mutta ei sovi B2, C2 ja N2. Jälkimmäisessä, homonuclear kaksiatomisen molekyylien (B2, C2 ja N2), vuorovaikutus tapahtuu välillä 2s-ja 2p atomic orbitaalit, jotka ovat tarpeeksi vahva vaihtaa tilaaminen σ2p ja n2p-molekyyli orbitaalit (Kuva 9.25).,
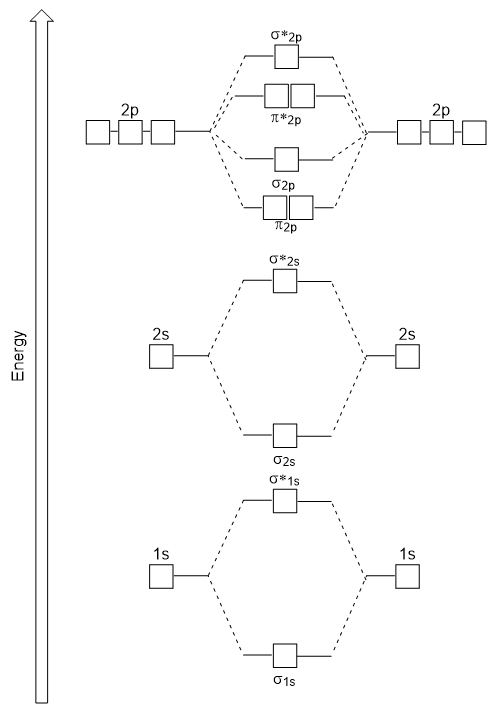
Heteronuclear Diatomic Molekyylejä,
heteronuclear kaksiatomisen molekyylien, jossa kaksi eri molekyylit ovat sitoutuneet, energia-tasot yksittäisten atomien’ atomic orbitaalit voivat vaihdella. Kuitenkin, molekyyliorbitaali kaavio näemme kuvassa 9.,25 (”Molecular orbital energia-kaavio homonuclear kaksiatomisen molekyylien valmistettu atomien järjestysluku 5-7”) voidaan käyttää arvioimaan, elektroni kokoonpano ja bond järjestyksessä.
Raja-Molekyyli Orbitaalit
– Emme voi keskittyä edelleen kaksi erittäin tärkeää tyypit molekyyli orbitaalit: korkein miehitetty molekyyli silmäkuopan (HOMO) ja alin tyhjillään molekyyli silmäkuopan (LUMO), jota kutsutaan myös yhteisnimellä raja-molekyyli orbitaalit (Kuva 9.26 ”Raja-molekyyli orbitaalit HOMO ja LUMO”)., Niiden nimet antavat ymmärtää, että HOMO on molecular orbital, joka on korkein energia ja sisältää elektroneja, kun LUMO on pienin energia molekyyli silmäkuopan, joka ei sisällä elektroneja.
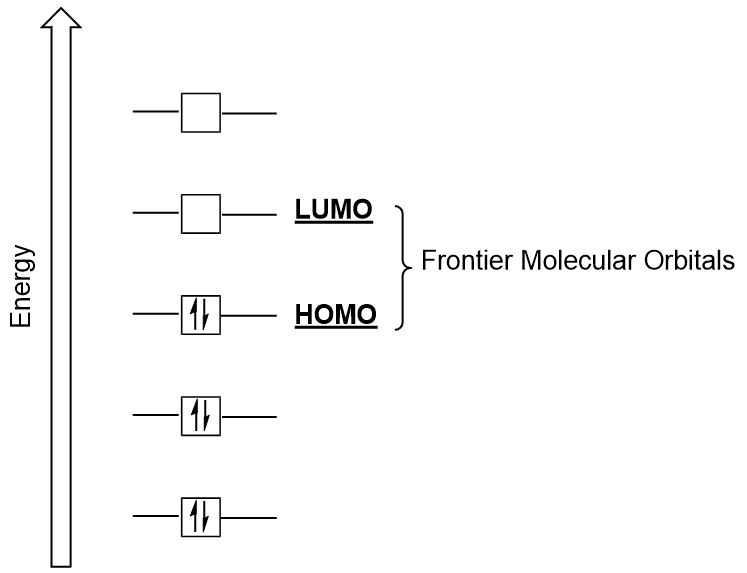
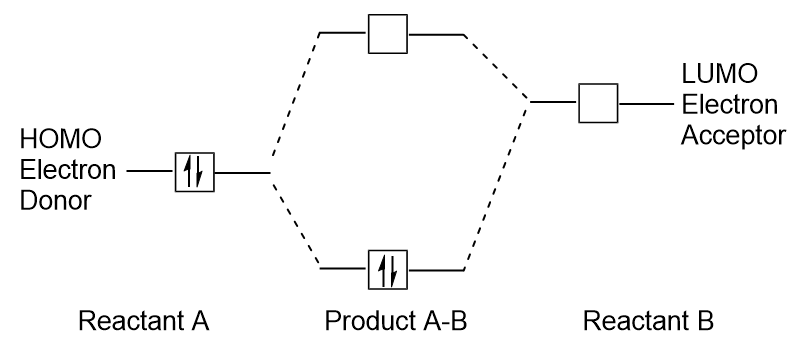
Kun molekyylit absorboivat energiaa, se on tyypillinen HOMO electron käyttää tämän energian siirtyminen maasta HOMO silmäkuopan LUMO innoissaan valtion kiertoradan., Tämän tyyppinen siirtyminen voidaan havaita ultravioletti-näkyvä (UV-Vis) säteilyn spektroskopia kokeissa. Samoin, monia kemiallisia reaktioita, yhden lähtöaineen molekyyli voi lahjoittaa HOMO elektroneja LUMO toisen lähtöaineen (Kuva 9.27 ”muodostetaan uusi liimaus molecular orbital yhdistämällä lähtöaineen HOMO ja LUMO”). Siksi rajan molekyyliorbitaalien energiatasojen ymmärtäminen voi tarjota kemisteille paljon ymmärrystä molekyylispektroskopian ja reaktiivisuuden alueilla.
Key Takeaways
- Atomi orbitaalit voidaan yhdistää tehdä liimaus ja antibonding molekyyli orbitaalit.
- Sidosrbitaalit ovat energialtaan matalampia kuin antibonding-orbitaalit.
- Molekyyliorbitaalit täytetään samanlaisin periaattein kuin atomiorbitaalit.
- Bond-tilauksen avulla voidaan arvioida sidoksen vahvuutta.
- Raja-molekyyli orbitaalit ovat erityisen tärkeitä molekyylispektroskopian ja reaktiivisuus.