objetivos de aprendizaje
- obtenga una comprensión de la teoría de orbitales moleculares.
- Aprenda a calcular órdenes de bonos.
- Aprenda a dibujar diagramas de energía de configuración electrónica orbital molecular.
La teoría del enlace de Valencia es capaz de explicar muchos aspectos del enlace, pero no todos. Para complementar esta teoría, usamos otra llamada teoría del orbital molecular (MO)., La teoría de orbitales moleculares es un modelo más sofisticado para entender la naturaleza del enlace químico.
la teoría MO lleva la idea de la superposición de orbitales atómicos a un nuevo nivel, donde se generan nuevos orbitales moleculares utilizando un proceso matemático llamado combinación lineal de orbitales atómicos (LCAO).
los orbitales moleculares comparten muchas similitudes con los orbitales atómicos:
– están llenos de energía más baja a energía más alta (principio de Aufbau).
– pueden contener un máximo de dos electrones de espín opuesto por orbital (principio de exclusión de Pauli).,
la principal diferencia entre los orbitales atómicos y moleculares es que los orbitales atómicos representan la densidad electrónica en el espacio asociada con un átomo en particular. Los orbitales moleculares están asociados con toda la molécula, lo que significa que la densidad electrónica se deslocaliza (se extiende) sobre más de un átomo.
los orbitales moleculares de la molécula de hidrógeno
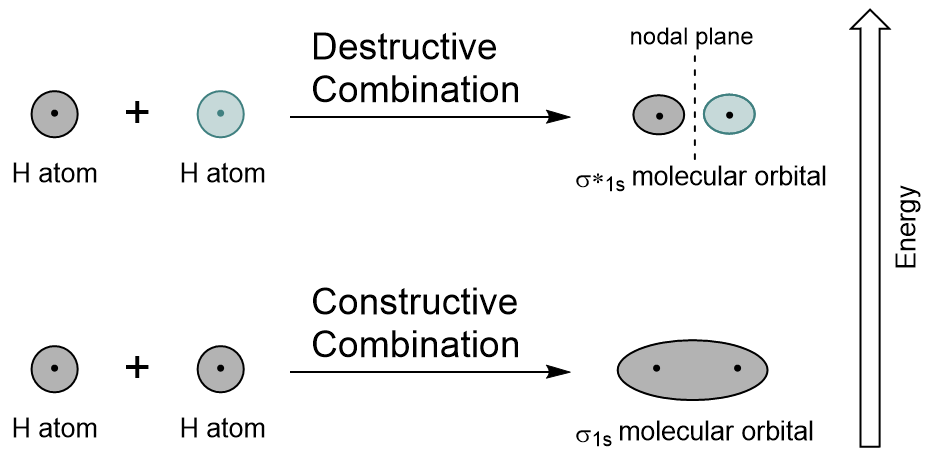
combinando los orbitales 1s de cada átomo de hidrógeno usando LCAO, se generan dos orbitales moleculares σ1s (pronunciado sigma uno s) y σ*1s (pronunciado sigma Estrella uno s).,
el Orbital σ1s es generado por una combinación constructiva (o interferencia), donde las dos funciones de onda orbitales atómicas se refuerzan (se suman) entre sí. Esta es la energía más baja de los dos orbitales moleculares y se conoce como el orbital molecular de enlace. Observe en la figura 9.19 «diagrama de combinación de orbitales moleculares de hidrógeno» que la densidad electrónica de este orbital se concentra entre los dos núcleos. Estos electrones son estabilizados por atracciones a ambos núcleos, y mantienen los átomos juntos con un enlace covalente.,
el Orbital σ * 1s es generado por una combinación destructiva (o interferencia), donde las funciones de onda de los dos orbitales atómicos se cancelan entre sí. Este tipo de combinación resulta en un área de densidad de electrones cero entre los dos núcleos, conocido como un plano nodal (o nodo). Este nodo de densidad de electrones cero se desestabiliza hacia el enlace, lo que lo hace de mayor energía, y posteriormente este tipo de orbital se conoce como un orbital molecular antibonding (denotado por el asterisco en el nombre orbital).
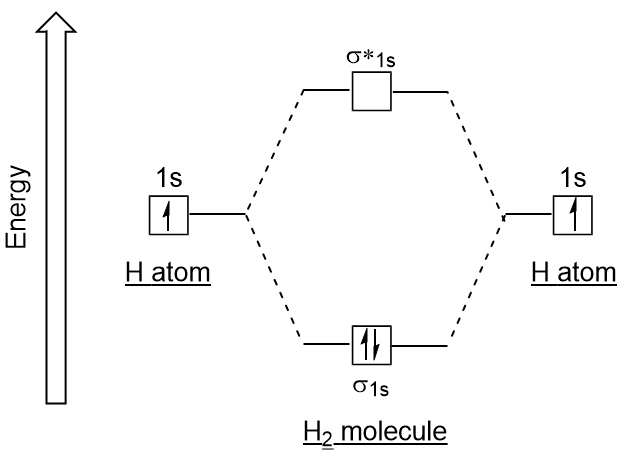
Similar a los orbitales atómicos, podemos escribir diagramas de energía de configuración electrónica para orbitales moleculares (figura 9.20 «diagrama de energía de configuración electrónica orbital molecular de hidrógeno»). Observe que los orbitales atómicos de cada átomo están escritos a cada lado, y los orbitales moleculares recién formados están escritos en el centro del diagrama., El orbital molecular de enlace está lleno y es relativamente más bajo en energía que los orbitales atómicos contribuyentes, lo que respalda el hecho de que las moléculas de hidrógeno (H2) son más estables que los átomos de hidrógeno solitarios.
orden de enlace
acabamos de ver que el orbital molecular de enlace es de menor energía y promueve la formación de un enlace covalente, mientras que el orbital molecular antibonding es de mayor energía con un nodo de densidad electrónica cero entre los átomos que desestabiliza la formación de un enlace covalente. Podemos evaluar la fuerza de un enlace covalente determinando su orden de enlace.
Bond order = 1/2 (#of electrons in bonding mos – # of electrons in antibonding mos)
Bond-order values can be whole numbers, fractions, or zero., Estos valores corresponden al modelo de enlace de Valencia, por lo que un orden de enlace de 1 es igual a un enlace simple, y 2 es igual a un enlace doble. Un valor de cero significa que no hay enlace presente, y los átomos existen por separado.
Ejemplo 11
Determinar el orden de enlace de la molécula de hidrógeno.
solución
orden de enlace = 1/2 (#of electrons in bonding mos – # of electrons in antibonding mos)
orden de enlace= 1/2 (2 – 0) = 1
Por lo tanto hay un enlace simple en la molécula de hidrógeno.,
orbitales moleculares de Li2
generar orbitales moleculares de moléculas más complejas que el hidrógeno usando el método LCAO requiere seguir algunas pautas adicionales:
– el número de MOs generados es igual al número de orbitales atómicos combinados.
– los orbitales atómicos combinados deben tener niveles de energía similares.
– la eficacia de la combinación Orbital atómica depende de la cantidad de superposición orbital. El mayor solapamiento disminuye aún más la energía del orbital molecular Enlazante, y aumenta la energía del orbital molecular antibonding.,
sigamos estas pautas y generemos un diagrama de configuración electrónica orbital molecular para Li2 (figura 9.21 «diagrama de energía de configuración electrónica orbital Molecular para dilitio»):
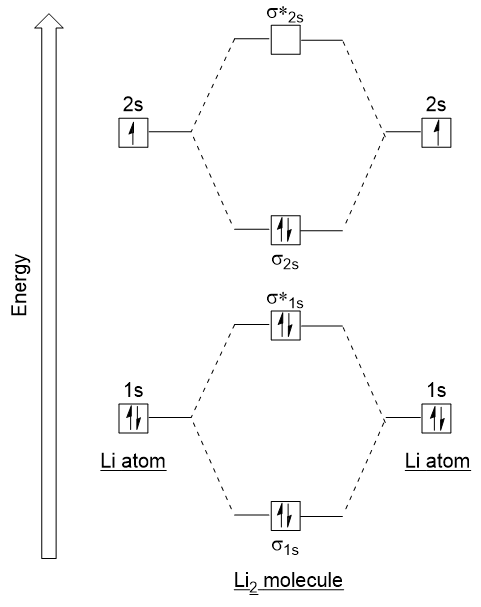
observe que hemos combinado los orbitales atómicos 1s, como antes en el ejemplo H2, para generar orbitales moleculares de enlace y antibonding que están completamente llenos por los electrones 1S de ambos átomos., De manera similar, los orbitales atómicos 2s se combinan, dando un orbital de enlace y un orbital antibonding, que se llenan con los electrones de Valencia restantes comenzando de abajo hacia arriba. Los orbitales atómicos que se combinan tienen niveles de energía similares; un orbital 1s no se combina con uno de los orbitales 2s.
el orden de enlace se puede determinar para esta molécula para ser:
orden de enlace = 1/2 (4 – 2) = 1
Por lo tanto Li2 tendría un solo enlace.,
orbitales moleculares de P orbitales atómicos
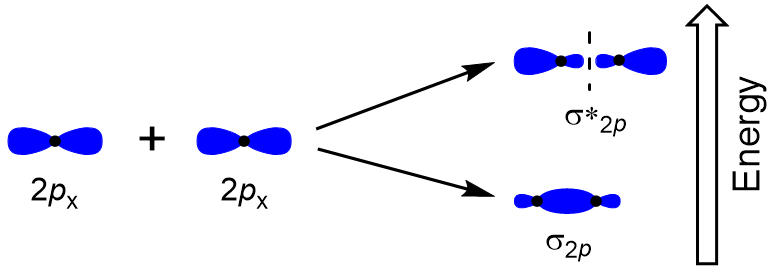
para determinar los orbitales moleculares de muchas otras moléculas, necesitamos examinar cómo los orbitales p se combinan para dar orbitales moleculares. Los orbitales p pueden superponerse de dos maneras: cabeza a cabeza o de lado. El solapamiento cabeza a cabeza de los orbitales atómicos p resulta en un orbital molecular Enlazante y antibonding, donde la densidad electrónica se centra a lo largo del eje internuclear, haciéndolos orbitales σ (figura 9.22 «solapamiento cabeza a cabeza de los orbitales p»).
la superposición lateral de los cuatro orbitales atómicos P restantes puede ocurrir a lo largo de los otros dos ejes, generando cuatro orbitales moleculares π que tienen densidad electrónica en lados opuestos del eje internuclear (figura 9.23″superposición lateral de orbitales p»).
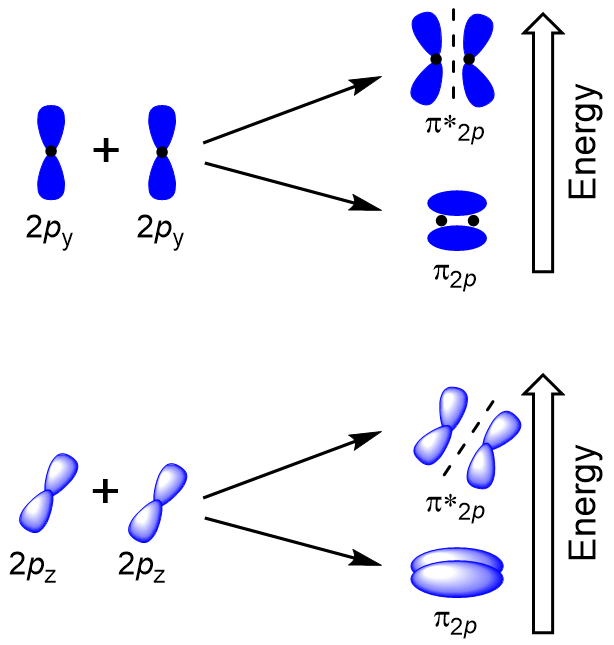
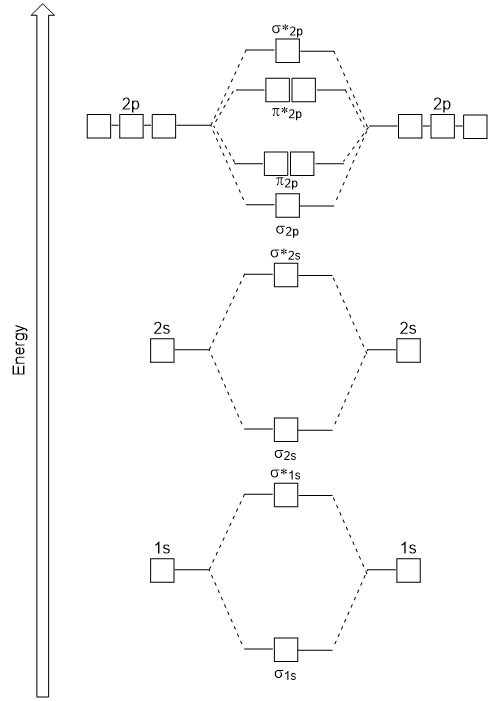
la superposición cabeza a cabeza que da σ orbitales moleculares da como resultado una mayor superposición, haciendo que su orbital molecular de enlace sea la energía más estable y más baja, mientras que el σ* antibonding es menos estable y tiene la energía más alta (figura 9.24″diagrama de energía orbital Molecular para moléculas diatómicas homonucleares hechas de átomos de número atómico 8-10″). La superposición lateral da cuatro orbitales moleculares π, dos orbitales moleculares de enlace degenerado de menor energía y dos orbitales antibonding de mayor energía.,
el diagrama de energía que acabamos de generar se ajusta experimentalmente con O2, F2 y Ne2, pero no se ajusta a B2, C2 y N2. En este último, moléculas diatómicas homonucleares (b2, C2 y N2), las interacciones tienen lugar entre los orbitales atómicos 2s y 2p que son lo suficientemente fuertes como para intercambiar el orden de los orbitales moleculares σ2p y N2P (figura 9.25).,
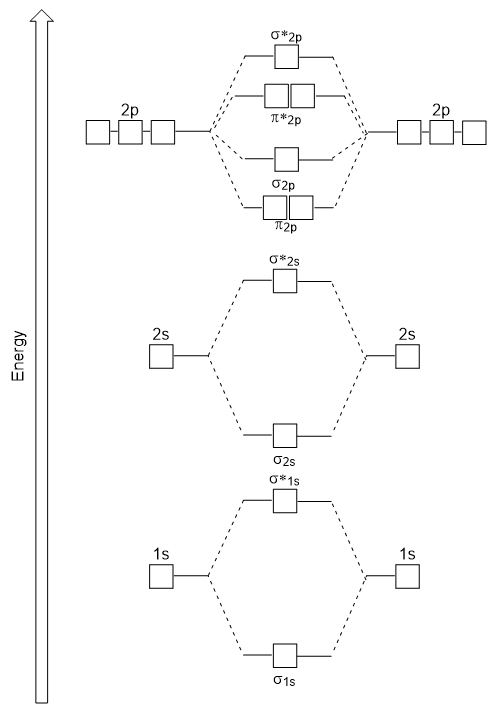
moléculas diatómicas Heteronucleares
en moléculas diatómicas heteronucleares, donde dos moléculas diferentes están unidas, los niveles de energía de los orbitales atómicos de los átomos individuales pueden diferir. Sin embargo, el diagrama orbital molecular que vemos en la Figura 9.,25 («Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 5-7») se puede utilizar para estimar la configuración electrónica y el orden de los enlaces.
orbitales moleculares Frontier
podemos centrarnos más en dos tipos muy importantes de orbitales moleculares: el orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO), también conocidos colectivamente como los orbitales moleculares frontier (figura 9.26 «orbitales moleculares Frontier HOMO y LUMO»)., Como sus nombres implican, el HOMO es el orbital molecular que tiene la energía más alta y contiene electrones, mientras que el LUMO es el orbital molecular de menor energía que no contiene electrones.
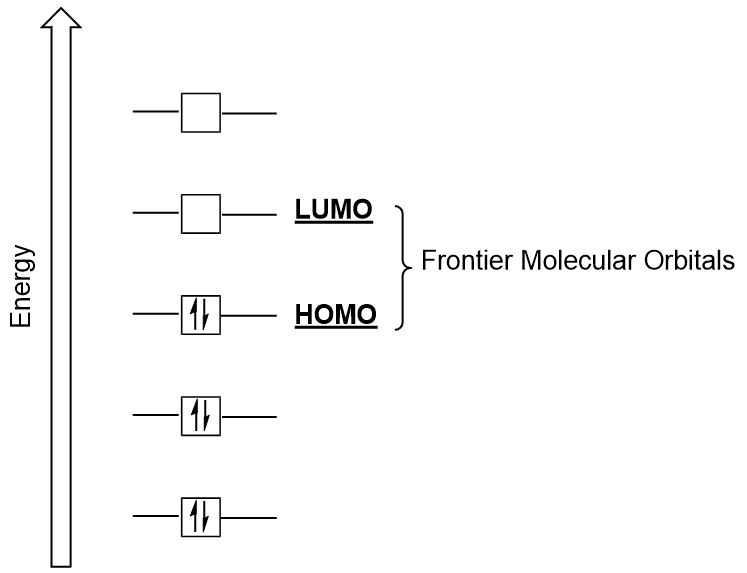
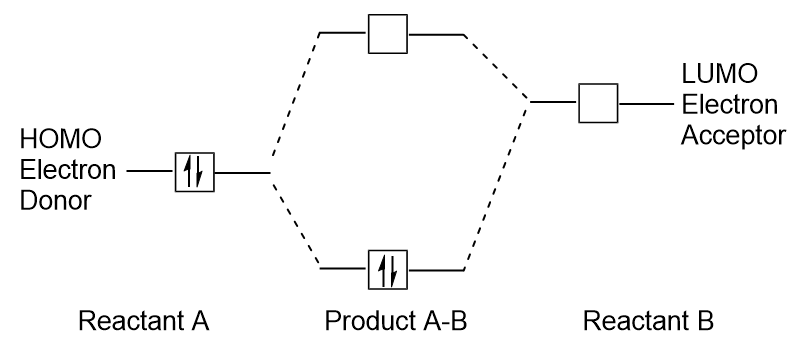
cuando las moléculas absorben energía, es típico que un homo electrón use esta energía para pasar del orbital homo terrestre al orbital de estado excitado LUMO., Este tipo de transición se puede observar en experimentos de espectroscopia de radiación ultravioleta-visible (UV-Vis). Además, en muchas reacciones químicas, una molécula de reactivo puede donar electrones HOMO al LUMO de otro reactivo (figura 9.27 «formación de un nuevo orbital molecular de enlace mediante la combinación de Homo reactivo y LUMO»). Por lo tanto, la comprensión de los niveles de energía orbital molecular de la frontera puede proporcionar a los químicos una gran cantidad de información en las áreas de la ESPECTROSCOPIA molecular y la reactividad.
Key Takeaways
- Los orbitales atómicos se pueden combinar para hacer orbitales moleculares de unión y antibonding.
- Los orbitales de unión son más bajos en energía que los orbitales antibonding.
- Los orbitales moleculares se rellenan usando principios similares a los orbitales atómicos.
- El orden de unión se puede utilizar para evaluar la resistencia de la Unión.
- Los orbitales moleculares Frontier son de particular importancia en la ESPECTROSCOPIA molecular y la reactividad.