Lernziele
- einen Einblick in molecular orbital theory.
- Lernen Sie, Anleiheaufträge zu berechnen.
- Lernen Sie, Energiediagramme für molekulare Orbitalelektronenkonfigurationen zu zeichnen.
Die Valenzbindungstheorie kann viele Aspekte der Bindung erklären, aber nicht alle. Um diese Theorie zu ergänzen, verwenden wir eine andere, die als Molecular Orbital (MO) – Theorie bezeichnet wird., Die molekulare Orbitaltheorie ist ein ausgefeilteres Modell zum Verständnis der Natur der chemischen Bindung.
Die MO-Theorie nimmt die Idee der Überlappung von Atomorbitalen auf eine neue Ebene, wo neue molekulare Orbitale unter Verwendung eines mathematischen Prozesses erzeugt werden, der als lineare Kombination von Atomorbitalen (LCAO) bezeichnet wird.
Molekulare Orbitale haben viele Ähnlichkeiten mit Atomorbitalen:
– Sie werden von der niedrigsten Energie zur höchsten Energie gefüllt (Aufbau-Prinzip).
– Sie können maximal zwei Elektronen mit entgegengesetztem Spin pro Orbital aufnehmen (Pauli-Ausschlussprinzip).,
Der Hauptunterschied zwischen atomaren und molekularen Orbitalen besteht darin, dass Atomorbitale die Elektronendichte im Raum darstellen, die einem bestimmten Atom zugeordnet ist. Molekulare Orbitale sind mit dem gesamten Molekül assoziiert, was bedeutet, dass die Elektronendichte über mehr als ein Atom delokalisiert (verteilt) ist.
Die molekularen Orbitale des Wasserstoffmoleküls
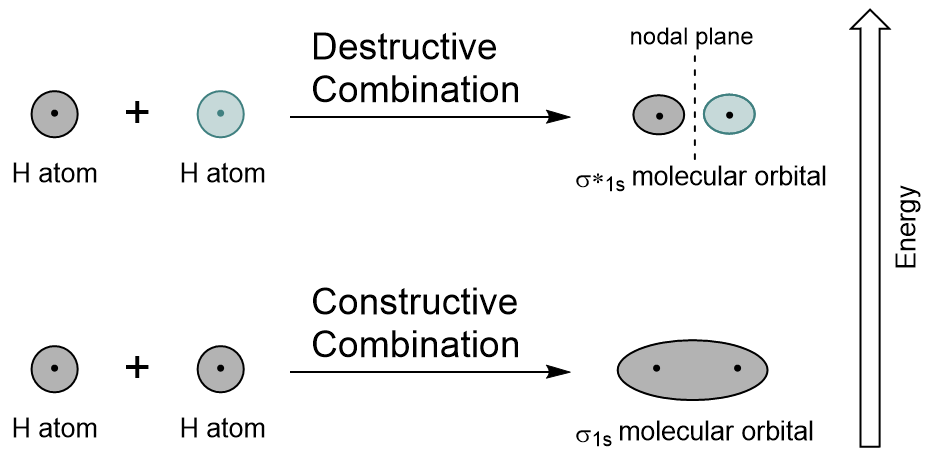
Durch die Kombination der 1s-Orbitale jedes Wasserstoffatoms unter Verwendung von LCAO werden zwei molekulare Orbitale σ1s (ausgesprochen sigma one s) und σ*1s (ausgesprochen sigma star one s) erzeugt.,
Das σ1s-Orbital wird durch eine konstruktive Kombination (oder Interferenz) erzeugt, bei der sich die beiden Atomorbitalwellenfunktionen gegenseitig verstärken (ergänzen). Dies ist die niedrigere Energie der beiden molekularen Orbitale und wird als bindendes molekulares Orbital bezeichnet. Beachten Sie in Abbildung 9.19 „Hydrogen molecular orbital combination diagram“, dass die Elektronendichte dieses Orbitals zwischen den beiden Kernen konzentriert ist. Diese Elektronen werden durch Anziehung auf beide Kerne stabilisiert und halten die Atome mit einer kovalenten Bindung zusammen.,
Das σ*1s-Orbital wird durch eine destruktive Kombination (oder Interferenz) erzeugt, bei der sich die Wellenfunktionen der beiden Atomorbitale gegenseitig aufheben. Diese Art der Kombination führt zu einem Bereich von Null Elektronendichte zwischen den beiden Kernen, bekannt als Knotenebene (oder Knoten). Dieser Knoten mit einer Elektronendichte von Null destabilisiert sich in Richtung der Bindung, wodurch er eine höhere Energie erhält, und anschließend wird diese Art von Orbital als Antibonding Molecular Orbital bezeichnet (bezeichnet mit dem Sternchen im Orbitalnamen).
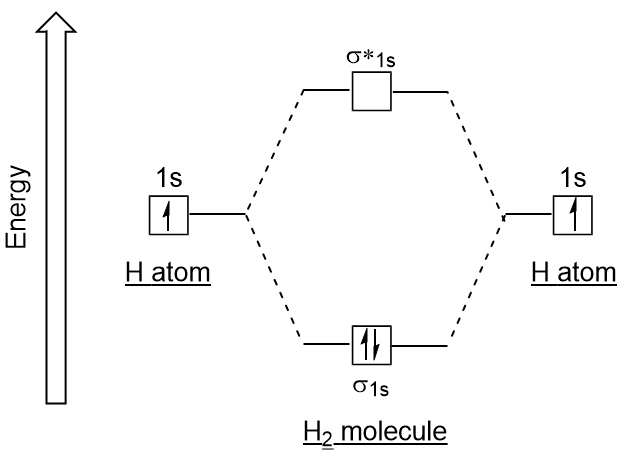
Ähnlich wie bei Atomorbitalen können wir Elektronenkonfigurationsenergiediagramme für molekulare Orbitale schreiben (Abbildung 9.20″Hydrogen molecular orbital electron configuration energy diagram“). Beachten Sie, dass die Atomorbitale jedes Atoms auf beiden Seiten geschrieben sind und die neu gebildeten molekularen Orbitale in der Mitte des Diagramms geschrieben sind., Das bindende molekulare Orbital ist gefüllt und hat eine relativ geringere Energie als die beitragenden Atomorbitale, was die Tatsache unterstützt, dass Wasserstoffmoleküle (H2) stabiler sind als einzelne Wasserstoffatome.
Bond Order
Wir haben gerade gesehen, dass das bindende molekulare Orbital eine niedrigere Energie ist und die Bildung einer kovalenten Bindung fördert, während das bindende molekulare Orbital eine höhere Energie mit einem Knoten mit null Elektronendichte zwischen den Atomen ist, der die Bildung einer kovalenten Bindung destabilisiert. Wir können die Stärke einer kovalenten Bindung bewerten, indem wir ihre Bindungsreihenfolge bestimmen.
Bond order = 1/2 (#von Elektronen in Bonding MOs – # von Elektronen in bonding MOs)
Bond-Order-Werte können ganze Zahlen, Brüche oder Null sein., Diese Werte entsprechen dem Valenzbindungsmodell, daher ist eine Bindungsreihenfolge von 1 gleich einer einzelnen Bindung und 2 gleich einer Doppelbindung. Ein Wert von Null bedeutet, dass keine Bindung vorhanden ist und die Atome getrennt existieren.
Beispiel 11
Bestimmen Sie die Bindungsreihenfolge des Wasserstoffmoleküls.
Lösung
Bond order = 1/2 (#von Elektronen in bonding MOs – # von Elektronen in bonding MOs)
Bond order = 1/2 (2 – 0) = 1
Deshalb gibt es eine einzelne Bindung im Wasserstoffmolekül.,
Molekulare Orbitale von Li2
Die Erzeugung molekularer Orbitale von Molekülen, die komplexer sind als Wasserstoff mit der LCAO– Methode, erfordert einige zusätzliche Richtlinien:
– Die Anzahl der erzeugten MOs entspricht der Anzahl der kombinierten Atomorbitale.
– Kombinierte Atomorbitale sollten ähnliche Energieniveaus haben.
– Die Wirksamkeit der atomaren Orbitalkombination hängt von der Menge der Orbitalüberlappung ab. Erhöhte Überlappung senkt die Energie des bindenden molekularen Orbitals weiter und erhöht die Energie des bindenden molekularen Orbitals.,
Folgen wir diesen Richtlinien und erzeugen ein molekulares Orbitalelektronenkonfigurationsdiagramm für Li2 (Abbildung 9.21 „Molekulares Orbitalelektronenkonfigurationsdiagramm für Dilithium“):
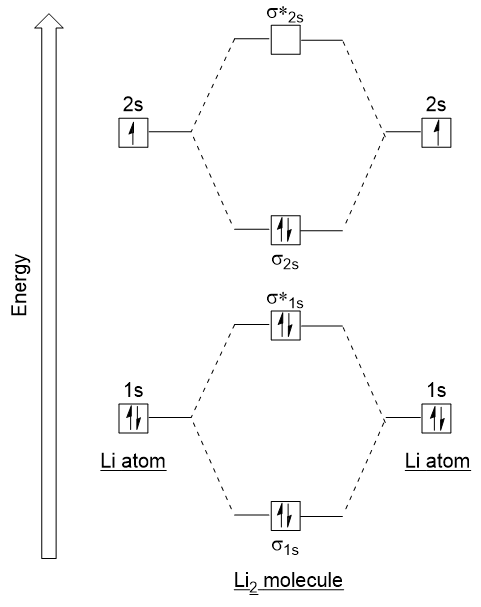
Beachten Sie, dass wir die 1s-Atomorbitale wie zuvor im H2-Beispiel kombiniert haben, um bindende und übereinstimmende molekulare Orbitale zu erzeugen, die vollständig von den 1s-Elektronen beider Atome gefüllt sind., In ähnlicher Weise verbinden sich Atomorbitale, was ein bindendes Orbital und ein bindendes Orbital ergibt, die von unten nach oben mit den verbleibenden Valenzelektronen gefüllt sind. Die Atomorbitale, die kombinieren, sind von ähnlichen Energieniveaus; ein 1s Orbital kombiniert nicht mit einem der 2s Orbitale.
Die Bindungsreihenfolge kann für dieses Molekül bestimmt werden:
Bindungsreihenfolge = 1/2 (4 – 2) = 1
Daher hätte Li2 eine einzige Bindung.,
Molekulare Orbitale aus p-Atomorbitalen
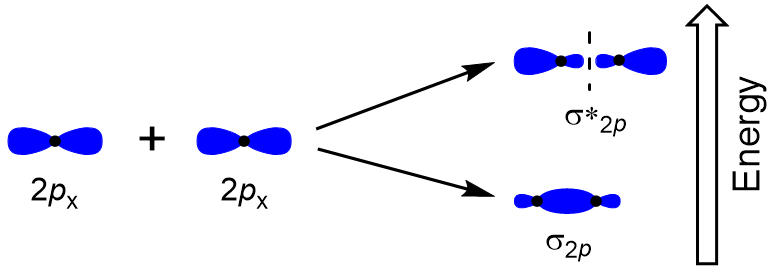
Um die molekularen Orbitale vieler anderer Moleküle zu bestimmen, müssen wir untersuchen, wie p-Orbitale molekulare Orbitale ergeben. Die P-Orbitale können sich auf zwei Arten überlappen: Kopf-an-Kopf oder seitwärts. Eine Kopf-an-Kopf-Überlappung von p-Atomorbitalen führt zu einem bindenden und übereinstimmenden molekularen Orbital, bei dem die Elektronendichte entlang der inneren Achse zentriert ist, wodurch sie σ-Orbitale bilden (Abbildung 9.22 „Kopf-an-Kopf-Überlappung von p-Orbitalen“).
Eine seitliche Überlappung der verbleibenden vier p-Atomorbitale kann entlang der beiden anderen Achsen auftreten und vier π-Molekülorbitale mit Elektronendichte auf gegenüberliegenden Seiten der internuklearen Achse erzeugen (Abbildung 9.23″Seitliche Überlappung der p-Orbitale“).
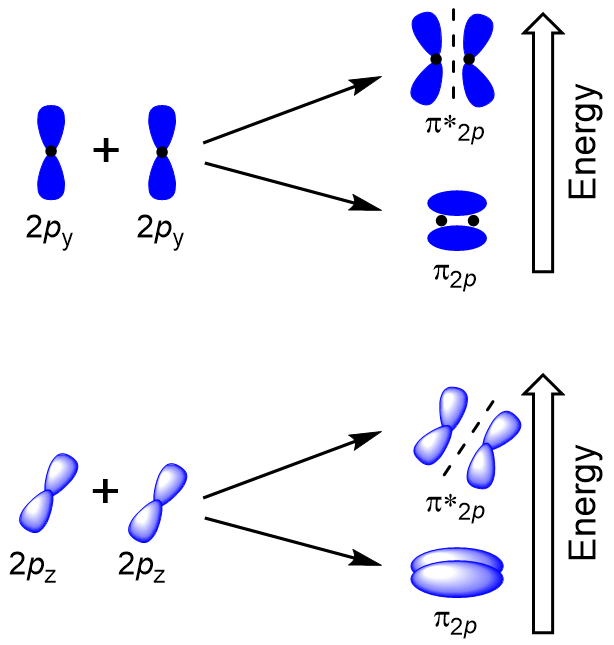
Die Kopf-an-Kopf-Überlappung, die σ – Molekülorbitale ergibt, führt zu einer größeren Überlappung, wodurch das bindende molekulare Orbital die stabilste und niedrigste Energie ist, während das σ* – Orbital am wenigsten stabil ist und die höchste Energie aufweist (Abbildung 9.24 „Molekulares Orbitalenergiediagramm für homonukleare zweiatomige Moleküle aus Atomen der Ordnungszahl 8-10“). Seitliche Überlappung ergibt vier π molekulare Orbitale, zwei niederenergetische degenerierte-bindende molekulare Orbitale und zwei hochenergetische degenerierte Orbitale.,
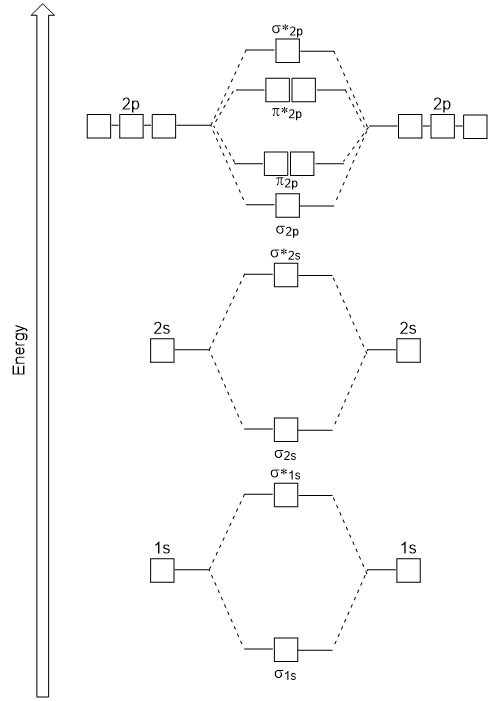
Das soeben erstellte Energiediagramm passt experimentell zu O2, F2 und Ne2, passt aber nicht zu B2, C2 und N2. In den letzteren homonuklearen zweiatomigen Molekülen (B2, C2 und N2) finden Wechselwirkungen zwischen den 2s-und 2p-Atomorbitalen statt, die stark genug sind, um die Reihenfolge der σ2p-und n2p-Molekülorbitale auszutauschen (Abbildung 9.25).,
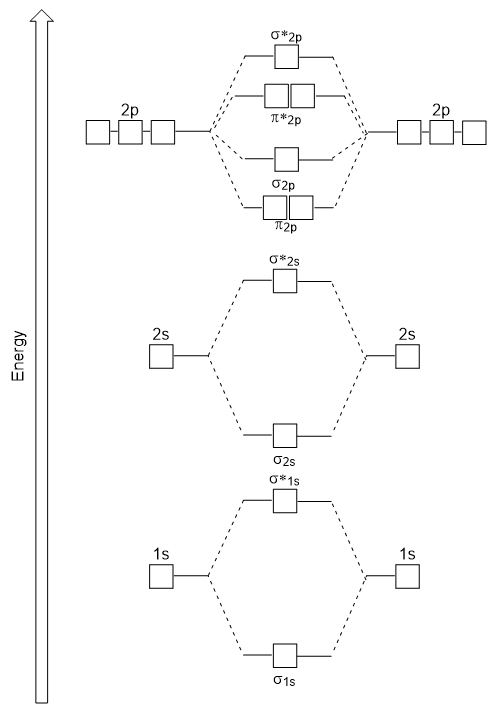
Heteronukleare zweiatomige Moleküle
Bei heteronuklearen zweiatomigen Molekülen, bei denen zwei verschiedene Moleküle gebunden sind, können die Energieniveaus der Atomorbitale der einzelnen Atome unterschiedlich sein. Das molekulare Orbitaldiagramm sehen wir jedoch in Abbildung 9.,25 („Molecular orbital energy-Diagramm für homonuclear zweiatomigen Moleküle aus Atomen der Ordnungszahl 5-7“) kann abgeschätzt werden, die Elektronenstruktur und Bindung bestellen.
Grenzmolekulare Orbitale
Wir können uns weiter auf zwei sehr wichtige Arten molekularer Orbitale konzentrieren: das höchste besetzte molekulare Orbital (HOMO) und das niedrigste unbesetzte molekulare Orbital (LUMO), auch kollektiv als grenzmolekulare Orbitale bezeichnet (Abbildung 9.26 „grenzmolekulare Orbitale HOMO und LUMO“)., Wie ihre Namen andeuten, ist der HOMO das molekulare Orbital, das die höchste Energie hat und Elektronen enthält, während das LUMO das molekulare Orbital mit der niedrigsten Energie ist, das keine Elektronen enthält.
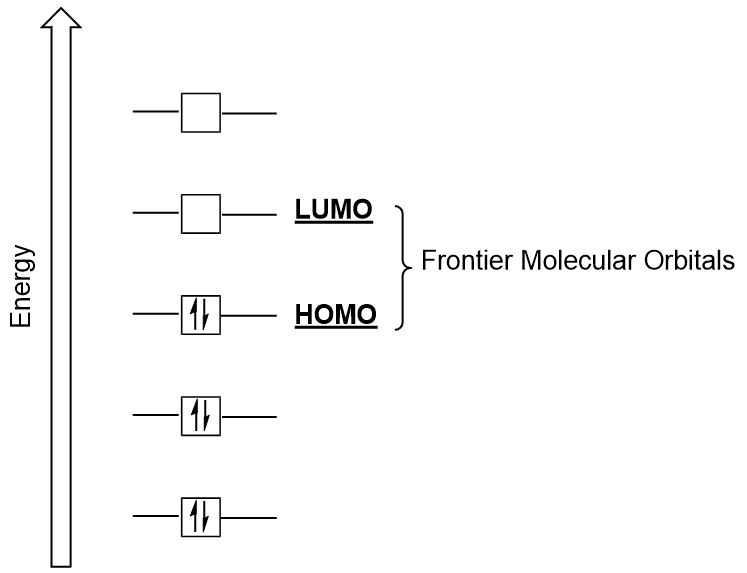
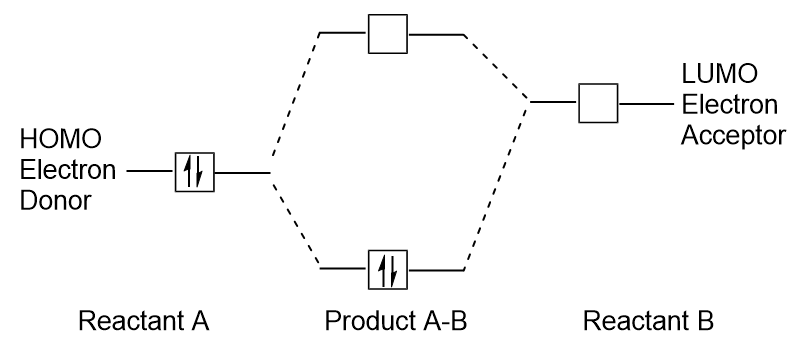
Wenn Moleküle Energie absorbieren, ist es typisch für ein HOMO-Elektron, diese Energie für den Übergang vom HOMO-Orbital zum LUMO-angeregten Orbital zu verwenden., Diese Art des Übergangs kann in UV-sichtbaren (UV-Vis) Strahlungsspektroskopieexperimenten beobachtet werden. In vielen chemischen Reaktionen kann ein Reaktantenmolekül auch Homoelektronen an das LUMO eines anderen Reaktanten spenden (Abbildung 9.27 „Bildung eines neuen bindenden molekularen Orbitals durch Kombination von Reaktantenhomo und LUMO“). Daher kann das Verständnis der molekularen orbitalen Energieniveaus Chemikern einen großen Einblick in die Bereiche molekulare Spektroskopie und Reaktivität geben.
Key Takeaways
- Atomic-orbitalen kombiniert werden können, um make-bonding-und antibonding molecular Orbital.
- Bonding-orbitale haben eine niedrigere Energie als antibonding orbitale.
- Molekulare Orbitale werden nach ähnlichen Prinzipien wie Atomorbitale gefüllt.
- Bond-Auftrag kann verwendet werden, zu bewerten Klebkraft.
- Die molekularen Orbitale sind in der molekularen Spektroskopie und Reaktivität von besonderer Bedeutung.