læringsmål
- Få en forståelse af, molecular orbital teori.
- Lær at beregne obligationsordrer.
- Lær at tegne molekylære orbital elektron konfiguration energi diagrammer.
Valence bond teori er i stand til at forklare mange aspekter af limning, men ikke alle. For at supplere denne teori bruger vi en anden kaldet molekylær orbital (MO) teori., Molekylær orbital teori er en mere sofistikeret model til forståelse af arten af kemisk binding.
MO teori tager ideen om atomare orbitaler overlappende til et nyt niveau, hvor nye molekylære orbitaler genereres ved hjælp af en matematisk proces kaldet lineær kombination af atomare orbitaler (LCAO).
molekylære orbitaler deler mange ligheder med atomare orbitaler:
– de er fyldt fra laveste energi til højeste energi (Aufbau-princippet).
– de kan holde maksimalt to elektroner af modsatte spin pr orbital (Pauli udelukkelse princip).,
den største forskel mellem atomare og molekylære orbitaler er, at atomare orbitaler repræsenterer elektrondensitet i rummet forbundet med et bestemt atom. Molekylære orbitaler er forbundet med hele molekylet, hvilket betyder, at elektrondensiteten er delokaliseret (spredt ud) over mere end et atom.
Den Molekylære Orbitals af Hydrogen-Molekyle
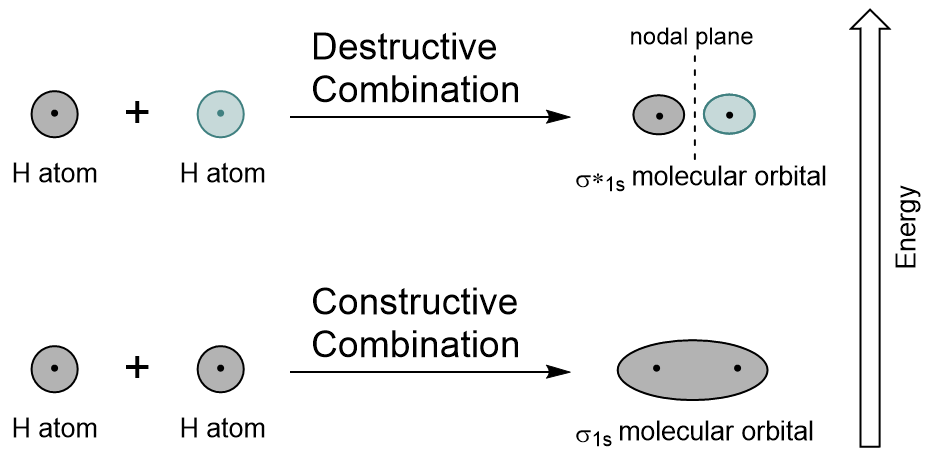
ved at Kombinere 1s orbitals af hvert hydrogenatom hjælp LCAO, to molekylær orbitals er genereret σ1s (udtales sigma one s) og σ*1s (udtales sigma star one s).,
orb1s-kredsløbet genereres af en konstruktiv kombination (eller interferens), hvor de to atomare orbitaler bølgefunktioner forstærker (tilføjer) hinanden. Dette er den lavere energi af de to molekylære orbitaler og er kendt som den bindende molekylære orbitale. Bemærk I figur 9.19″ Hydrogen molecular orbital combination diagram”, at elektrondensiteten af denne orbital er koncentreret mellem de to kerner. Disse elektroner stabiliseres af attraktioner til begge kerner, og de holder atomerne sammen med en kovalent binding.,
Orb*1s-kredsløbet genereres af en destruktiv kombination (eller interferens), hvor bølgefunktionerne i de to atomorbitaler annullerer hinanden. Denne type kombination resulterer i et område med nul elektrondensitet mellem de to kerner, kendt som et knudeplan (eller knudepunkt). Denne node med nul elektrondensitet destabiliserer mod bindingen, hvilket gør den højere energi, og efterfølgende er denne type orbital kendt som en antibonding molekylær orbital (betegnet med stjernen i orbitalnavnet).
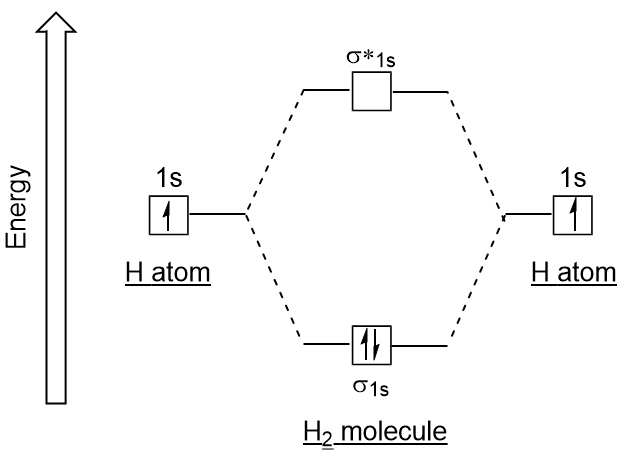
i lighed med atomare orbitaler kan vi skrive elektronkonfigurationsenergidiagrammer for molekylære orbitaler (figur 9.20 “Hydrogen molecular orbital electron configuration energy diagram”). Bemærk, at de atomare orbitaler af hvert atom er skrevet på hver side, og de nydannede molekylære orbitaler er skrevet i midten af diagrammet., Den bindende molekylære orbitale er fyldt og er relativt lavere i energi end de medvirkende atomorbitaler, hvilket understøtter det faktum, at hydrogenmolekyler (H2) er mere stabile end ensomme hydrogenatomer.
Bond For
Vi har lige set, at limning molecular orbital er et lavere energiforbrug og fremmer dannelsen af en kovalent binding, mens antibonding molecular orbital er højere energi med en node af nul elektron densitet mellem de atomer, der destabiliserer dannelsen af en kovalent binding. Vi kan evaluere styrken af en kovalent obligation ved at bestemme dens obligationsordre.
Bond order = 1/2 (# af elektroner i bonding MOs – # af elektroner i antibonding MOs)
Bond-ordensværdier kan være hele tal, fraktioner eller nul., Disse værdier svarer til valensbindingsmodellen, så en bindingsordre på 1 er lig med en enkelt binding, og 2 er lig med en dobbeltbinding. En værdi på nul betyder, at der ikke er nogen binding til stede, og atomerne findes separat.eksempel 11
Bestem bindingsrækkefølgen for hydrogenmolekylet.
Løsningen
Bond for = 1/2 (# af elektroner i bonding MOs – # af elektroner i antibonding MOs)
Bond for = 1/2 (2 – 0) = 1
Derfor, at der er en enkelt obligation i hydrogen-molekyle.,
Molekylær Orbitals af Li2
Generering molekylær orbitals af molekyler, der er mere komplekse end brint ved hjælp af den LCAO metode kræver, at du efter et par yderligere retningslinjer:
– antallet af MOs, der genereres, er lig med antallet af atomare orbitals kombineret.
– kombinerede atomorbitaler skal have lignende energiniveauer.
– effektiviteten af atomare orbital kombination afhænger af mængden af orbital overlapning. Øget overlapning sænker energien i den bindende molekylære orbital yderligere og hæver energien i den antibonderende molekylære orbital.,
Lad os følge disse retningslinjer og generere en molecular orbital elektron konfiguration diagram for Li2 (Figur 9.21 “Molecular orbital elektron konfiguration energi diagram for dilithium”):
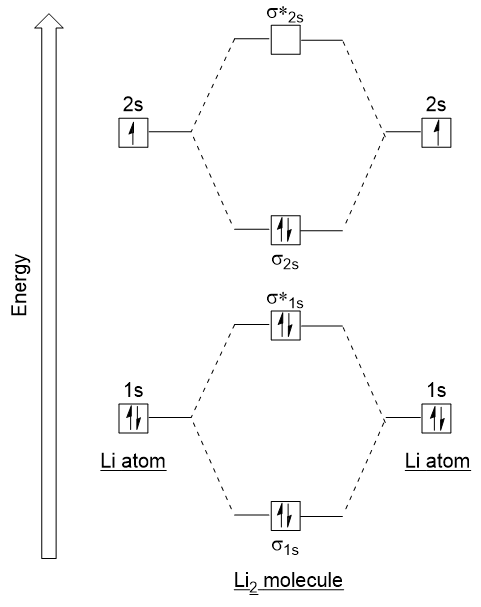
Bemærk, at vi har kombineret 1s-atomorbitalerne, som før i H2-eksemplet, for at generere binding og antibonding molekylære orbitaler, der er fuldstændigt fyldt af begge atomers 1s-elektroner., Tilsvarende kombinerer 2s atomorbitaler, hvilket giver en bindings orbital og en antibonding orbital, som er fyldt med de resterende valenselektroner, der starter fra bunden opad. De atomare orbitaler, der kombinerer, har lignende energiniveauer; en 1s orbitale kombinerer ikke med en af 2s orbitalerne.
bindingsrækkefølgen kan bestemmes for dette molekyle at være:
Bondordre = 1/2 (4 – 2) = 1
derfor Li2 ville have en enkelt obligation.,
molekylære orbitaler fra P atomare orbitaler
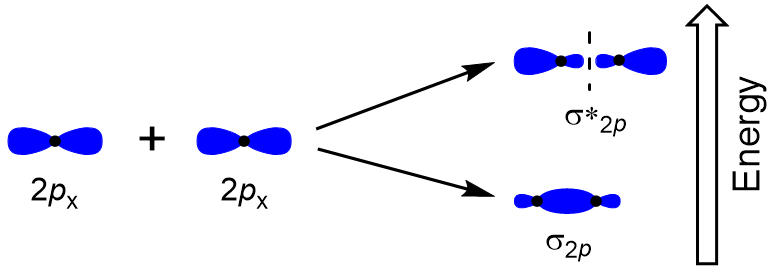
for at bestemme molekylære orbitaler af mange andre molekyler skal vi undersøge, hvordan p orbitaler kombineres for at give molekylære orbitaler. P-orbitalerne kan overlappe hinanden på to måder: head-to-head eller sidelæns. Head-to-Head overlapning af s atomic orbitals resultater i en limning og antibonding molecular orbital, hvor elektron densitet er centreret langs internuclear akse, hvilket gør dem σ orbitals (Figur 9.22 “Head-to-Head overlapning af p orbitals”).
Sidelæns overlapning af de resterende fire p atomic orbitals kan forekomme sammen med de to andre akser skaber fire π molekylær orbitals der elektron densitet på modsatte sider af internuclear aksen (Figur 9.23 “Sidelæns overlapning af p orbitals”).
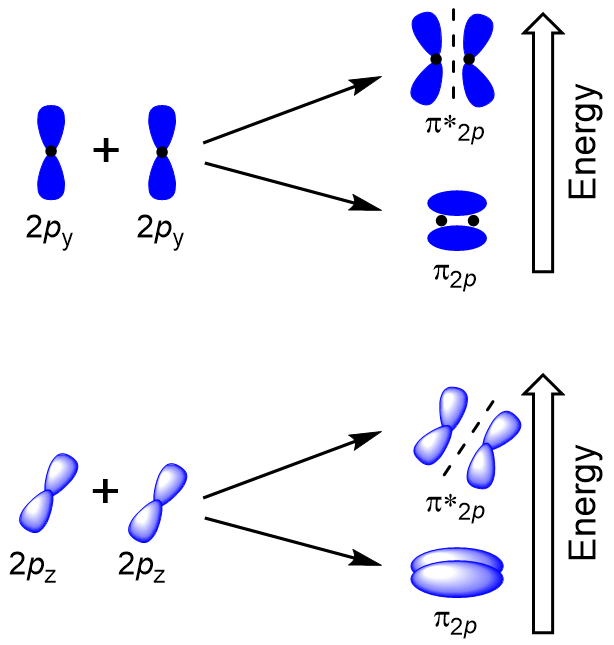
ead-to-head overlapper give σ molekylær orbitals resulterer i større overlapning, som gør sine limning molecular orbital den mest stabile og laveste energi, mens σ* antibonding er mindst stabile og har den højeste energi (Figur 9.24 “Molecular orbital energi diagram for homonuclear diatomare molekyler, der er lavet af atomer af atomnummer 8-10”). Side .ays overlap giver fire molecular molekylære orbitaler, to lavere energi degenereret-bonding molekylære orbitaler, og to højere energi antibonding orbitaler.,
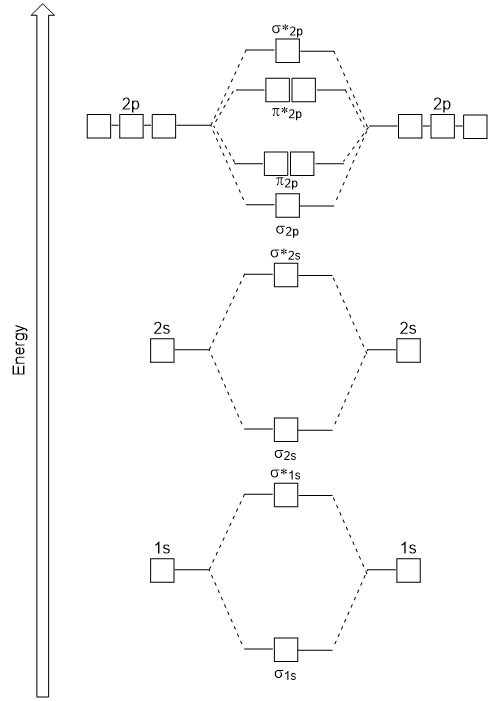
det energidiagram, vi netop har genereret, passer eksperimentelt med O2, F2 og Ne2, men passer ikke til B2, C2 og N2. I sidstnævnte finder homonukleære diatomiske molekyler (B2, C2 og N2) interaktioner sted mellem 2s og 2p atomorbitaler, der er stærke nok til at bytte rækkefølgen af molecular2p og n2p molekylære orbitaler (figur 9.25).,
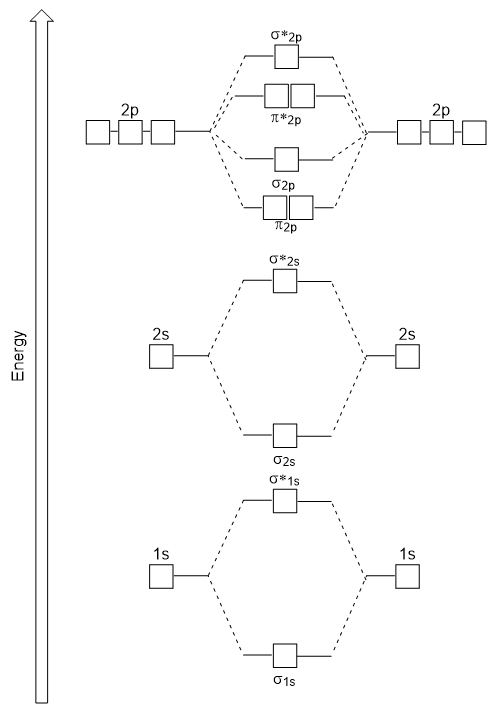
Heteronuclear Diatomare Molekyler
I heteronuclear diatomare molekyler, hvor to forskellige molekyler, der er bundet, energi-niveauer af de enkelte atomer’ atomic orbitals kan variere. Imidlertid er det molekylære orbitaldiagram, vi ser i figur 9.,25 (“Molekylær orbital energidiagram for homonukleære diatomiske molekyler fremstillet af atomer med atomnummer 5-7”) kan bruges til at estimere elektronkonfigurationen og bindingsrækkefølgen.
Grænse Molekylær Orbitals
Vi kan yderligere fokus på to meget vigtige typer af molekylære orbitals: den højeste besat molecular orbital (HOMO) og den laveste ubesatte molecular orbital (LUMO), også kollektivt refereret til som frontier molekylær orbitals (Figur 9.26 “Frontier molekylær orbitals HOMO og LUMO”)., Som deres navne siger, HOMO er molecular orbital, der har den højeste energi og indeholder elektroner, mens LUMO er den laveste energi molecular orbital, der ikke indeholder elektroner.
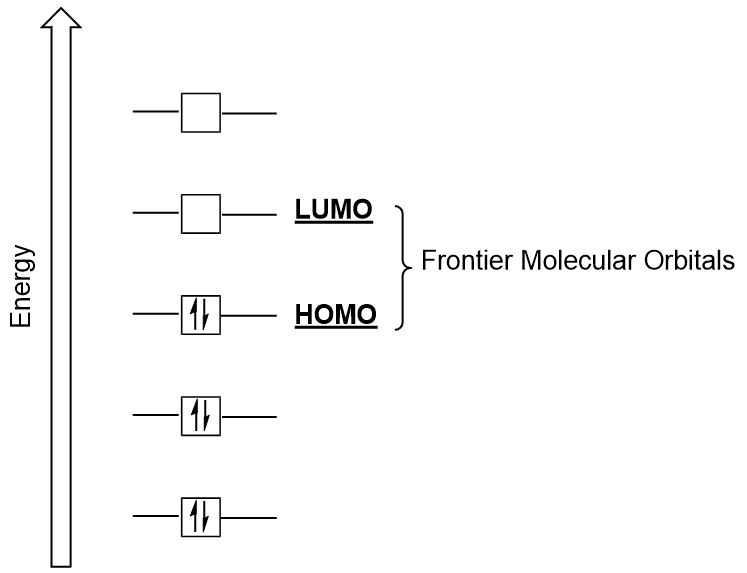
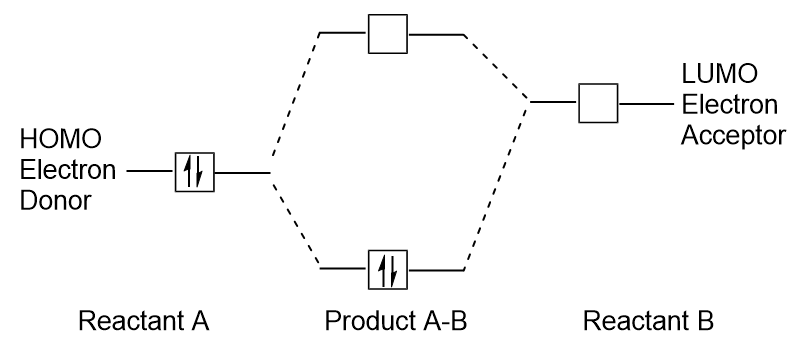
Når molekyler absorberer energi, det er typisk for en HOMO electron at bruge denne energi til at overgangen fra jorden HOMO orbital til LUMO ophidset tilstand orbital., Denne type overgang kan observeres i ultraviolet-synlige (UV-Vis) strålingsspektroskopiforsøg. Samt, i mange kemiske reaktioner, en reaktant-molekyle kan donere HOMO elektroner til LUMO af en anden reaktant (Figur 9.27 “Dannelsen af en ny binding molecular orbital ved at kombinere reaktant HOMO og LUMO”). Derfor kan forståelse af grænsemolekylære orbital energiniveauer give kemikere en stor indsigt inden for molekylær spektroskopi og reaktivitet.
nøgle Takea .ays
- atomare orbitaler kan kombineres for at gøre binding og antibonding molekylære orbitaler.
- Bonding orbitaler er lavere i energi end antibonding orbitaler.
- molekylære orbitaler er fyldt under anvendelse af lignende principper til atomare orbitaler.
- Bond ordre kan bruges til at evaluere bond styrke.
- Grænsemolekylære orbitaler er af særlig betydning ved molekylær spektroskopi og reaktivitet.