Cíle Vzdělávání
- porozumět molekulární orbitální teorie.
- Naučte se vypočítat příkazy dluhopisů.
- Naučte se kreslit energetické diagramy konfigurace molekulárních orbitálních elektronů.
teorie valenční vazby je schopna vysvětlit mnoho aspektů lepení, ale ne všechny. K doplnění této teorie používáme jinou teorii nazývanou molekulární orbitální (MO) teorie., Molekulární orbitální teorie je sofistikovanější model pro pochopení povahy chemické vazby.
mo teorie bere myšlenku atomových orbitalů překrývajících se na novou úroveň, kde nové molekulární orbitaly jsou generovány pomocí matematického procesu zvaného lineární kombinace atomových orbitalů (LCAO).
molekulární orbitaly sdílejí mnoho podobností s atomovými orbitaly:
– jsou naplněny od nejnižší energie k nejvyšší energii (princip Aufbau).
– mohou pojmout maximálně dva elektrony opačného spinu na orbital (Pauliho vylučovací princip).,
hlavní rozdíl mezi atomovými a molekulárními orbitaly spočívá v tom, že atomové orbitaly představují elektronovou hustotu ve vesmíru spojenou s konkrétním atomem. Molekulární orbitaly jsou spojeny s celou molekulou, což znamená, že elektronová hustota je delokalizována (rozložena) na více než jednom atomu.
Molekulové Orbitaly Molekuly Vodíku
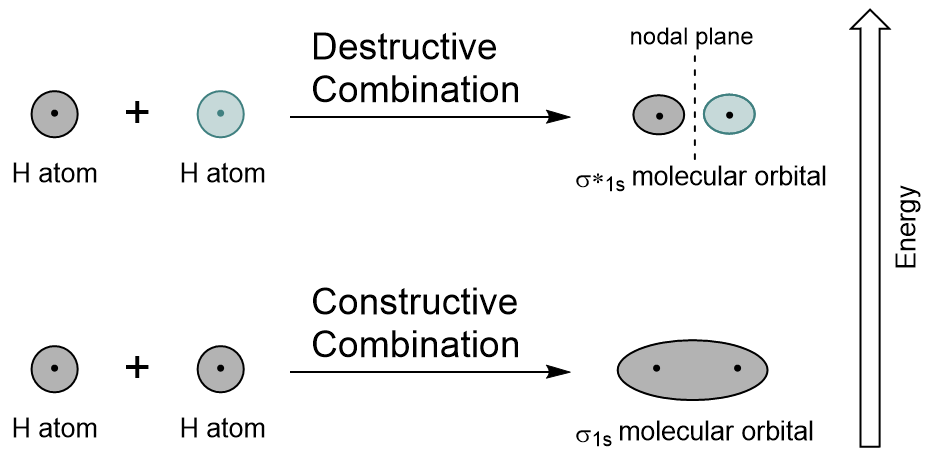
Kombinace 1s orbitalů každého atomu vodíku pomocí LCAO, dva molekulové orbitaly jsou generovány σ1s (vyslovuje se sigma one s) a σ*1s (vyslovuje se sigma star one s).,
orbitalu σ1s je generován konstruktivní kombinace (nebo rušení), kde dva atomové orbitaly vlnové funkce posílení (přidat do) navzájem. Toto je nižší energie dvou molekulárních orbitalů a je známá jako vazebná molekulární orbital. Na obrázku 9.19 „schéma kombinace molekulových orbitalů vodíku“ všimněte si, že elektronová hustota tohoto orbitalu je koncentrována mezi dvěma jádry. Tyto elektrony jsou stabilizovány přitažlivostí obou jader a drží atomy spolu s kovalentní vazbou.,
σ*1s orbital je generován destruktivní kombinací (nebo interferencí), kde se vlnové funkce obou atomových orbitálů navzájem ruší. Tento typ kombinace má za následek oblast nulové elektronové hustoty mezi dvěma jádry, známou jako uzlová rovina (nebo uzel). Tento uzel nulová elektronová hustota je destabilizující k dluhopisu, což je vyšší energie, a následně tento typ orbitalu je známý jako antibonding molekulární orbital (označený hvězdičkou v orbitální jméno).
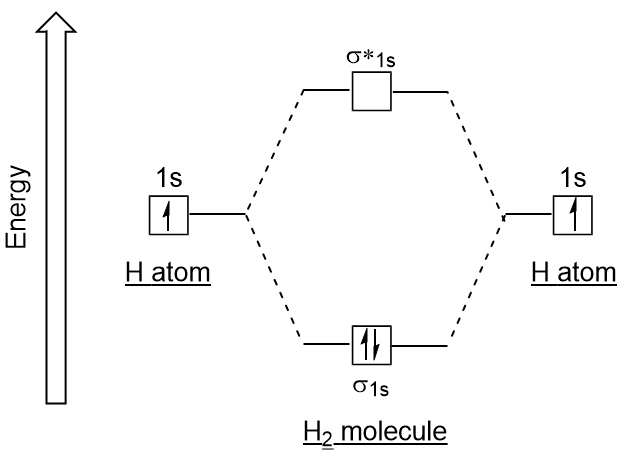
Podobné atomových orbitalů, můžeme napsat elektronovou konfiguraci energetické diagramy molekulových orbitalů (Obrázek 9.20 „Vodík molekulový orbital elektronová konfigurace energie diagram“). Všimněte si, že atomové orbitaly každého atomu jsou napsány na obou stranách a nově vytvořené molekulární orbitaly jsou napsány ve středu diagramu., Lepení molekulární orbital je zaplněn a je relativně nižší obsah energie, než přispívat atomové orbitaly, podporující skutečnost, že molekuly vodíku (H2), jsou více stabilní než osamělé atomy vodíku.
Bond Objednávky
právě Jsme viděli, že lepení molekulový orbital má nižší energii a podporuje tvorbu kovalentní vazbou, zatímco antibonding molekulový orbital má vyšší energii s uzlu nulová elektronová hustota mezi atomy, které destabilizuje vytvoření kovalentní vazby. Sílu kovalentní vazby můžeme vyhodnotit určením jejího dluhopisového řádu.
Bond order = 1/2 (# elektronů v lepení MOs – # elektronů v antibonding MOs)
Bond-order hodnoty mohou být celá čísla, zlomky, nebo žádné., Tyto hodnoty odpovídají modelu valenční vazby, takže dluhopisový řád 1 se rovná jediné vazbě a 2 se rovná dvojité vazbě. Hodnota nuly znamená, že neexistuje žádná vazba a atomy existují odděleně.
příklad 11
určuje pořadí vazby molekuly vodíku.
Řešení
Bond order = 1/2 (# elektronů v lepení MOs – # elektronů v antibonding MOs)
Pouto, aby = 1/2 (2 – 0) = 1
a Proto je jednoduchá vazba ve vodíkové molekule.,
Molekulové Orbitaly z Li2
Vytváří molekulové orbitaly molekul složitější než vodík pomocí LCAO metoda vyžaduje následující několik dalších pokynů:
– počet MOs generované je roven počtu atomových orbitalů v kombinaci.
– kombinované atomové orbitaly by měly mít podobnou energetickou hladinu.
– účinnost atomové orbitální kombinace závisí na množství orbitálního překrytí. Zvýšené překrytí dále snižuje energii vazebného molekulárního orbitalu a zvyšuje energii antibondingového molekulárního orbitalu.,
řekněme, postupujte podle těchto pokynů a vytvářet molekulární orbital elektronová konfigurace diagramu pro Li2 (viz Obrázek 9.21 „Molekulární orbital elektronová konfigurace energetický diagram pro dilithia“):
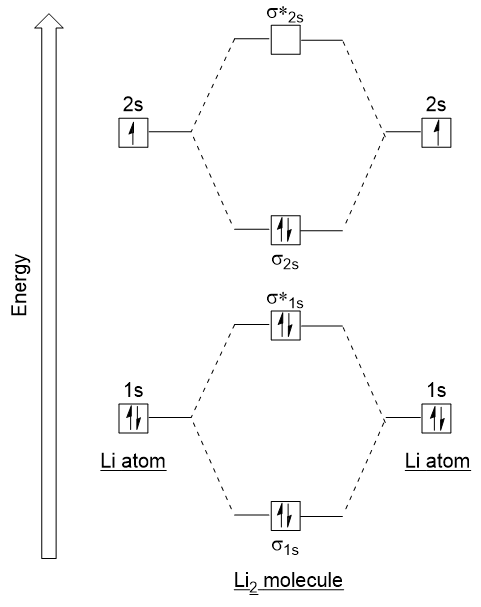
Všimněte si, že jsme spojili 1s atomové orbitaly, jako předtím v H2 příklad, generovat lepení a antibonding molekulové orbitaly, které jsou zcela vyplněny oba atomy‘ 1s elektrony., Podobně se kombinují atomové orbitaly 2S, které poskytují spojovací orbital a antibondingový orbital, které jsou naplněny zbývajícími valenčními elektrony počínaje zdola nahoru. Atomové orbitaly, které se kombinují, mají podobné energetické hladiny; orbital 1s se nekombinuje s jedním z orbitálů 2S.
pořadí vazby může být určeno pro to, aby tato molekula byla:
pořadí vazby = 1/2 (4 – 2) = 1
proto by Li2 měla jednu vazbu.,
Molekulové Orbitaly z p Atomové Orbitaly
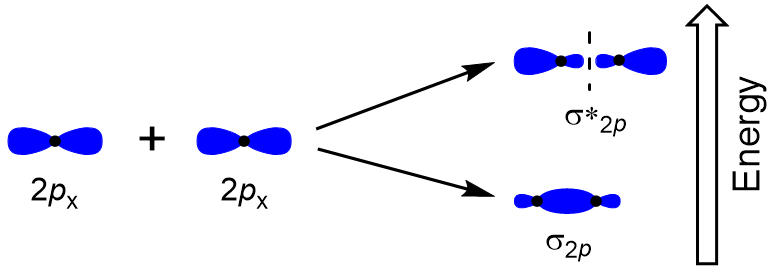
K určení molekulové orbitaly mnoha jiných molekul, musíme zkoumat, jak se p orbitaly kombinovat dát molekulové orbitaly. P orbitaly se mohou překrývat dvěma způsoby: hlava-hlava nebo bokem. Hlava-k-hlava překrytí p atomové orbitaly výsledky v lepení a antibonding molekulární orbital, kde je elektronová hustota je soustředěna podél internuclear osy, což je σ orbitaly (Obrázek 9.22 „hlava-k-Hlava překrytí p-orbitaly“).
Boční překrytí zbývající čtyři p atomové orbitaly může dojít po dalších dvou osách, vytváří čtyři π-molekulové orbitaly s elektronovou hustotu na opačných stranách internuclear osy (Obrázek 9.23 „Bokem překrytí p-orbitaly“).
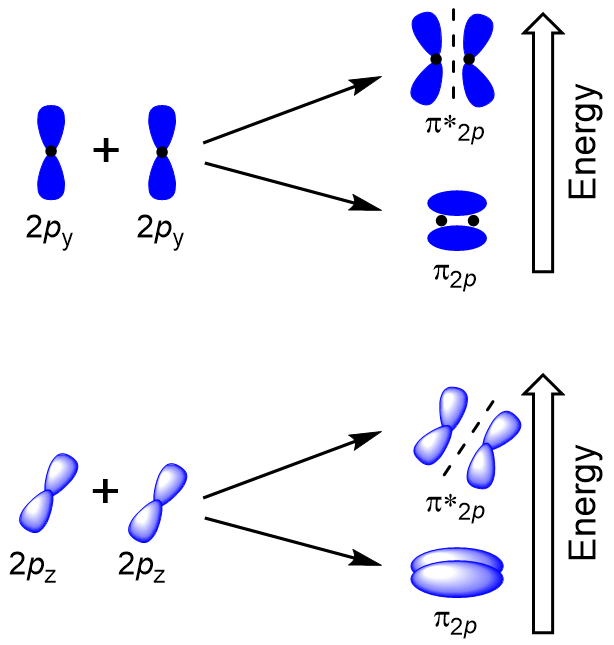
hlava-k-hlava se překrývají, což σ molekulových orbitalů má za následek větší přesah, takže jeho lepení molekulární orbital nejstabilnější a nejnižší energie, zatímco σ* antibonding je nejméně stabilní a má nejvyšší energii (Obrázek 9.24 „Molekulární orbitální energie diagram pro homonuclear diatomic molekul vyrobeny z atomů, atomové číslo 8-10“). Boční překrytí dává čtyři π molekulové orbitaly, dva molekulární orbitaly s nižší energií, a dva antibondingové orbitaly s vyšší energií.,
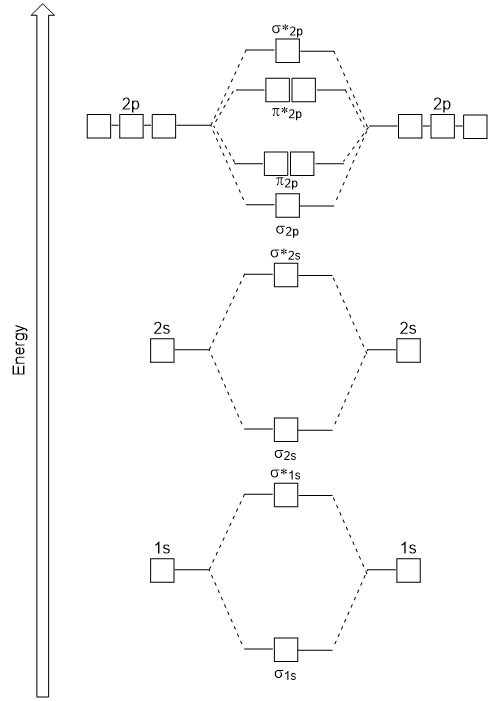
energie diagramu máme jen generované odpovídá experimentálně s O2, F2 a Ne2, ale nehodí se pro B2, C2 a N2. V druhé, homonuclear diatomic molekul (B2, C2 a N2), interakce probíhají mezi 2s a 2p atomových orbitalů, které jsou dostatečně silné, aby swap objednání σ2p a n2p molekulové orbitaly (Obrázek 9.25).,
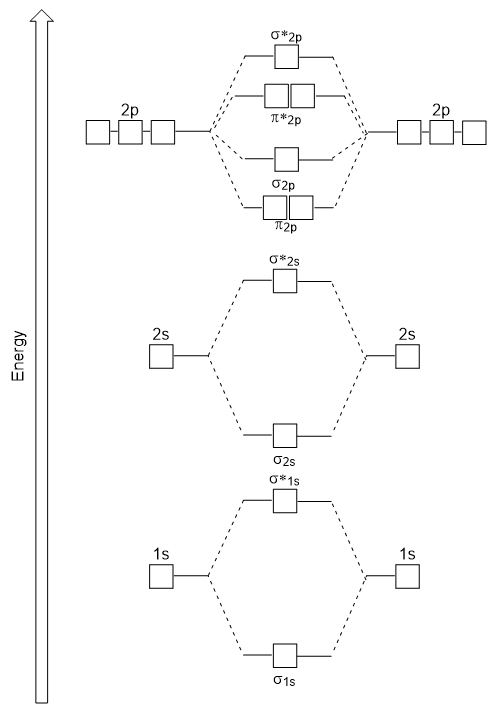
Heteronuclear Diatomic Molekul
V heteronuclear diatomic molekul, kde dvě různé molekuly jsou vázány, energetické hladiny jednotlivých atomů, atomové orbitaly se mohou lišit. Molekulární orbitální diagram však vidíme na obrázku 9.,25 („Molecular orbital energy diagram for homonuklear diatomic molecules made from atoms of atomic number 5-7“) lze použít k odhadu konfigurace elektronů a pořadí vazeb.
Hraniční Molekulové Orbitaly
se můžeme zaměřit dále na dva velmi důležité typy molekulární orbitaly: nejvyšší obsazený molekulární orbital (HOMO) a nejnižší neobsazený molekulový orbital (LUMO), také označované souhrnně jako hraniční molekulové orbitaly (Obrázek 9.26 „Hraniční molekulové orbitaly HOMO a LUMO“)., Jak naznačují jejich jména, HOMO je molekulární orbital který má nejvyšší energii a obsahuje elektrony, zatímco LUMO je nejnižší energii molekulární orbital, který neobsahuje elektrony.
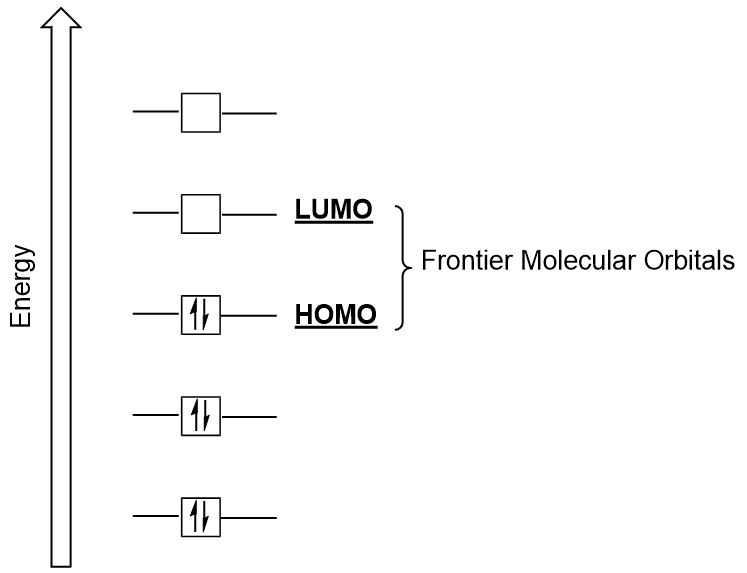
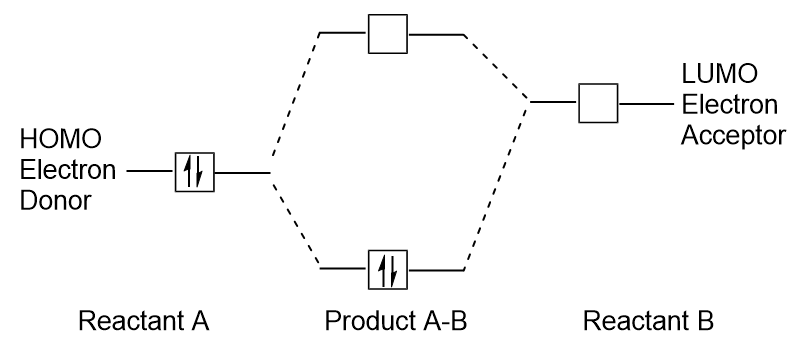
Když molekuly absorbují energii, to je typické pro HOMO elektron použít tuto energii k přechodu od země HOMO orbital na LUMO nadšená-státní orbital., Tento typ přechodu lze pozorovat v ultrafialově viditelných (UV-Vis) radiačních spektroskopických experimentech. Také v mnoha chemických reakcích může jedna molekula reaktantu darovat HOMO elektrony LUMO jiného reaktantu (obrázek 9.27 „vytvoření nového vazebného molekulárního orbitalu kombinací reaktantu HOMO a LUMO“). Pochopení hladin molekulární orbitální energie na hranicích proto může chemikům poskytnout velký přehled v oblastech molekulární spektroskopie a reaktivity.
Klíčové Takeaways
- Atomové orbitaly můžeme spojit, aby lepení a antibonding molekulové orbitaly.
- spojovací orbitaly mají nižší energii než antibondingové orbitaly.
- molekulární orbitaly jsou naplněny podobnými principy jako atomové orbitaly.
- příkaz vazby lze použít k vyhodnocení síly vazby.
- hraniční molekulární orbitaly mají zvláštní význam v molekulární spektroskopii a reaktivitě.