LANGE ANTWORT. Zunächst muss zwischen der Polarität einer Bindung und der Polarität eines Moleküls (oder einer Verbindung) unterschieden werden.
Die Bindungspolarität bezieht sich auf eine Trennung der elektrischen Ladung, die sich aus einem Unterschied in der Elektronegativität zwischen den beiden Atomen oder Gruppen ergibt, die sich verbinden.,
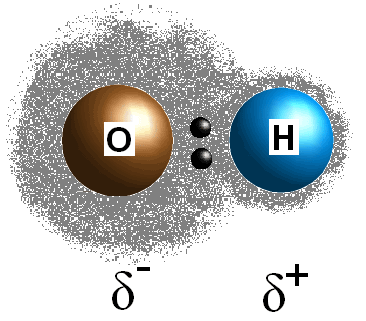
Dieser Unterschied in den Elektronegativitätswerten zwischen den beiden Atomen bewirkt, dass die Elektronen der Bindung ungleich geteilt werden, wodurch eine postive Ladung (#delta^+#) auf dem weniger elektronegativen Atom und eine teilweise negative Ladung (#delta^(-)#) auf dem elektronegativeren Atom erzeugt wird. Die Polarität einer Bindung kann ausschließlich anhand der Elektronegativitätswerte der beiden konstituierenden Atome bestimmt werden.
Wenn die Bindung zwischen den beiden Atomen nicht polar ist, d. h. der Unterschied in der Elektronegativität zwischen den beiden Atomen ist kleiner als 0.,5, dann wird Ihr Molekül unpolar sein. Wenn die Bindung tatsächlich polar ist, können Sie versuchen, die Polarität des Moleküls zu bestimmen.
Die Geometrie eines Moleküls ist ein wichtiger Faktor bei der Bestimmung der Polarität eines Moleküls. Diese vorgenannten Teilladungen führen zu einem Bond-Dipolmoment, #mu#.
Wenn sich die Orientierungen dieser Bindungsdipolmomente gegenseitig aufheben, dann gilt das Molekül als unpolar. Wenn sie dies jedoch nicht tun, haben Sie es mit einem polaren Molekül zu tun.,
Einige Beispiele, bei denen Bond-Dipolmomente sich gegenseitig aufheben, was zu einem unpolaren Molekül führt:
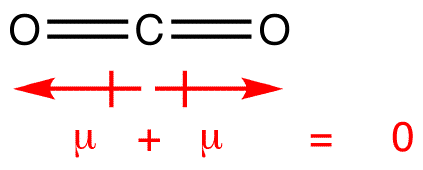
Dipolmomente werden mit dem Pfeil gezeichnet, der auf das elektronegativere Atom und die Plusseite auf das weniger elektronegative Atom zeigt. Beachten Sie, dass für #CO_2#, das zwei polare Bindungen hat, das gesamte Dipolmoment Null ist, da sich diese beiden Pfeile gegenseitig aufheben. Dies führt zu einem unpolaren Molekül., Gleiches gilt für #BF_3#:
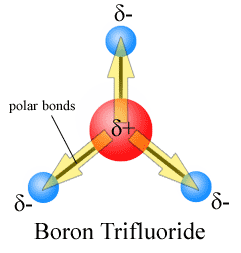
Die drei Dipolmomente heben sich durch die symmetrische Anordnung der Bindungen gegenseitig auf (siehe mehr zur Vektoraddition).
Eine assymetrische Anordnung der Teilladungen ergibt ein polares Molekül, wie Sie für Wasser sehen können:
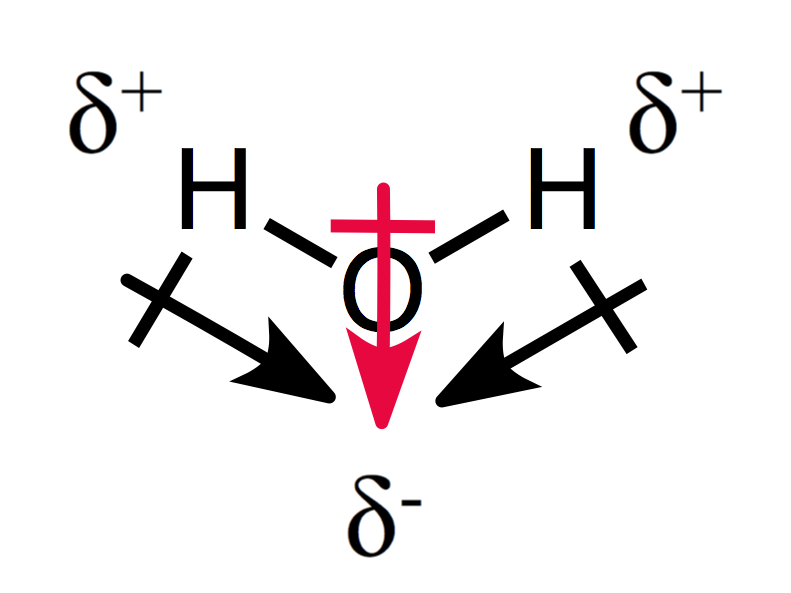
Die beiden Dipolmomente addieren sich zu einem Gesamtdipolmoment und damit zu einem polaren Molekül.,
Um die Polarität eines Moleküls vorherzusagen, müssen Sie mit Lewis-Strukturen, Elektronegativität, VSEPR-Theorie und Bindungspolarität vertraut sein.