US-Pharm. 2020;45(9):27-29.
ZUSAMMENFASSUNG: Da synthetische Hormone erstmals in den 1940er Jahren kombiniert wurden, wurde die Hormonersatztherapie häufig von Frauen angewendet, bei denen unerwünschte Symptome der Menopause auftraten. Nachfolgende Forschungen führten zu Entdeckungen mehrerer negativer Auswirkungen im Zusammenhang mit der Hormontherapie und lösten Diskussionen über die Risiken und Vorteile einer Hormonbehandlung aus., Aufgrund der mit kommerziellen Präparaten verbundenen Risiken ist die compoundierte Hormontherapie (CHT) stärker ausgeprägt, da sie als biologisch äquivalente Alternative zu synthetischen Hormonen angepriesen wurde. Aufgrund der minimalen bis keiner FDA-Aufsicht im Bereich der Compoundierung im Allgemeinen ist CHT jedoch möglicherweise nicht so sicher wie angekündigt. Im Jahr 2018 wurde Bijuva aufgrund günstiger Testergebnisse die erste von der FDA zugelassene bioidentische Kombination aus 17-Beta-Estradiol-Progesteron-Formulierung.,
Seit Jahrzehnten wenden sich Frauen einer Hormonersatztherapie zu, um unerwünschte vasomotorische Symptome im Zusammenhang mit den Wechseljahren wie Hitzewallungen und Nachtschweiß zu behandeln. Frauen können bis zu einem Drittel ihres Lebens in einem Hormonmangel verbringen, was zu unerwünschten Wirkungen wie Stimmungsschwankungen, erhöhtem Osteoporoserisiko und verminderter Libido beiträgt. Systemisches Östrogen ist die wirksamste Behandlung für vasomotorische Symptome, während urogenitale Symptome im Zusammenhang mit den Wechseljahren mit niedrig dosiertem topischem Östrogen behandelt werden sollten.,1 Die Beobachtungsstudie zur Gesundheit von Frauen im ganzen Land ergab, dass Frauen nach den Wechseljahren durchschnittlich 7, 4 Jahre lang vasomotorische Symptome haben.2 Die meisten Kliniker empfehlen jedoch, die Behandlung nach den Wechseljahren nicht länger als 5 Jahre zu dauern, und empfehlen dringend, die Hormontherapie bei Frauen über 60 Jahren insgesamt zu vermeiden.1 Der Arzt sollte die mit synthetischen und zusammengesetzten Hormonen verbundenen Risiken und Vorteile sorgfältig abwägen und dabei das Hauptziel der Verbesserung der Lebensqualität des Patienten berücksichtigen.,
Bioidentische Hormone
Bioidentische Hormone wie Östrogene, Gestagene und Androgene sind Verbindungen, die gemäß USP-Kapitel <795> Nichtsterile Compoundierungsstandards hergestellt werden. Diese Hormone können in einer Vielzahl von Dosierungen und Darreichungsformen zusammengesetzt werden, wodurch viele Optionen für Frauen geschaffen werden, die an einer zusammengesetzten Hormontherapie (CHT) interessiert sind., Compoundierte Formulierungen werden nicht den strengen Herstellungs-und Reinheitsstandards unterzogen, die ihre FDA-zugelassenen Kollegen durchführen; Trotz dieser unregulierten Umgebung ist CHT bei Patienten, die mehr „personalisierte“ Medizin suchen, sehr beliebt.
Die Endokrine Gesellschaft hat zusammengesetzte bioidentische Hormone als „Verbindungen definiert, die genau die gleiche chemische und molekulare Struktur haben wie Hormone, die im menschlichen Körper produziert werden.,“3 Die FDA behauptet, dass der Begriff bioidentisches Hormon eine reine Marketingstrategie ist, da es keine wissenschaftliche Grundlage für eine implizite Nutzen-oder Risikominderung für CHT gegenüber einer von der FDA zugelassenen synthetischen Hormontherapie gibt.3
Synthetische Hormontherapie
Die FDA genehmigte 1941 Diethylstilbestrol und 1942 konjugierte Pferdeöstrogene (CEE) zur Behandlung von Wechseljahrsbeschwerden.4 Ab den 1960er Jahren stiegen die Östrogenverkäufe bis 1975 in die Höhe, als Berichte auftauchten, dass der Östrogenkonsum mit einem erhöhten Risiko für Endometriumkarzinome einhergehen könnte.,4 Diese Berichte wurden jedoch weitgehend ignoriert und der Östrogenkonsum fortgesetzt. Erst 1996, als die postmenopausale Östrogen/Gestagen-Interventionen (PEPI) – Studie veröffentlicht wurde, begannen Gesundheitsdienstleister, die potenziellen negativen Auswirkungen der Östrogentherapie wirklich zu verstehen. PEPI war eine 3-jährige randomisierte, placebokontrollierte, doppelblinde, multizentrische Studie, in der die histologischen Endometriumeffekte der Therapie mit synthetischem, nicht aufgehaltenem Östrogen im Vergleich zu drei verschiedenen Therapien von synthetischem Östrogen plus Gestagen untersucht wurden.,5
In der PEPI-Studie entwickelten signifikant mehr Probanden, denen Östrogen allein verabreicht wurde, eine einfache, komplexe oder atypische Endometriumhyperplasie als Probanden, denen Placebo verabreicht wurde (TABELLE 1). Während die genauen Prozentsätze nicht angegeben wurden, waren die Hyperplasieraten bei Probanden, denen eines der drei Östrogen-plus-Gestagen-Therapien verabreicht wurde, ähnlich denen bei Probanden, denen Placebo verabreicht wurde.5 Zusammenfassend Verabreichung von Östrogen allein in einer Dosierung von 0.,625 mg pro Tag führten zu einer signifikant erhöhten Inzidenz von Endometriumhyperplasie, während die Kombination von CEE mit Gestagen das Endometrium in erheblichem Maße vor Überwachsen schützte.5 Aufgrund dieses nachgewiesenen Endometriumkarzinomrisikos wird Gestagen bei Frauen mit intakter Gebärmutter immer in Kombination mit Östrogen verabreicht. Zur Bestätigung dieses Risikos wurden in einer Fallserie von 2007 drei Frauen beschrieben, die CHT mit subtherapeutischen Dosen von Gestagen verwendeten und später Endometriumkarzinom entwickelten.,6
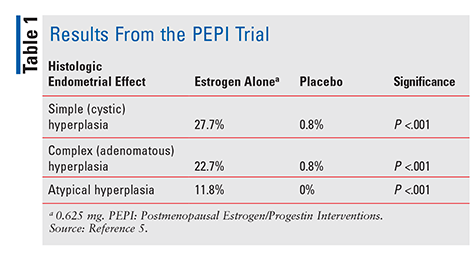
Die PEPI-Studie sowie die Ergebnisse zu 16.068 postmenopausalen Frauen aus der 2002 veröffentlichten Women ‚ s Health Initiative (WHI) beleuchteten die ernsten Bedenken, die in den 1970er Jahren aufgeworfen wurden.7 Obwohl die PEPI-Studie kein erhöhtes Risiko für Hyperplasie mit dem Kombinationsprodukt zeigte, stellte die WHI fest, dass die Risiken im Zusammenhang mit dem Konsum synthetischer Hormone wie als Herz-Kreislauf-Erkrankungen, Schlaganfall, thromboembolische Ereignisse und Brustkrebs.,7 Bei 1 Jahr nach Absetzen der Kombinations-CEE/Medroxyprogesteronacetat-Therapie bestand ein um 80% erhöhtes Risiko für Herz-Kreislauf-Erkrankungen und ein um 37% erhöhtes Risiko für einen ischämischen Schlaganfall während der Interventionsphase mit Kombinationstherapie. Auch das Brustkrebsrisiko war während der Intervention signifikant erhöht (24%). Die Anwendung von Östrogen-plus-Gestagen hatte einige Vorteile, wobei die Patienten eine verringerte Inzidenz von vaginaler Atrophie, verminderte vasomotorische Symptome wie Hitzewallungen und Nachtschweiß und ein um 38% verringertes Risiko für Darmkrebs während der Behandlung mit Kombinationstherapie feststellten.,7 Aufgrund der Bedeutung des erhöhten Brustkrebsrisikos und thromboembolischer Ereignisse wurde die Studie jedoch vorzeitig abgebrochen.
Compounded Hormon Therapy
Die oben diskutierten Risiken ebneten den Weg für die CHT-Interessenvertretung, da angenommen wurde, dass die Anpassung oder Personalisierung von CHT an den einzelnen Patienten den Nutzen maximieren und das Risiko minimieren würde. Behauptungen, dass CHT sicherer und biologisch freundlicher war, wurden bekannter und seine Verwendung nahm zu., Pinkerton und Santoro verwendeten zwei verschiedene Umfragen—Harris und Rose—, um das Wissen der Patienten über CHT zu bewerten und die Verwendung von CHT im Vergleich zur von der FDA zugelassenen Hormontherapie zu quantifizieren.8 Ergebnisse der Harris-Umfrage zeigten, dass 86% der Frauen im Alter von 40 bis 65 Jahren nicht wussten,dass CHT nicht von der FDA zugelassen war, und extrapolierte Ergebnisse der Rose-Umfrage deuteten darauf hin, dass jährlich bis zu 2,5 Millionen Frauen älter als 40 Jahre CHT verwenden können.8 Daten aus beiden Umfragen zeigten, dass ein Arzt oder Apotheker CHT empfohlen hatte., Diese Ergebnisse legen nahe, dass Anbieter die Möglichkeit haben, sicherzustellen, dass Patienten über das Produkt informiert werden, das sie erhalten, einschließlich aller möglichen Risiken im Zusammenhang mit der Hormontherapie, und Apotheker zusammenzustellen, um sicherzustellen, dass sie ein therapeutisch reines Produkt liefern, dem Patienten vertrauen können.
Da die FDA nicht für die Standardisierung von compoundierten Produkten verantwortlich ist, fällt die Regulierung häufig an staatliche Apothekenbehörden., Diese Boards verfügen normalerweise nicht über die Ressourcen, um regelmäßige Inspektionen von Compoundierapotheken durchzuführen, und die FDA greift nur ein, wenn eine Beschwerde eingereicht wird.9 Obwohl zusammengesetzte Formulierungen gesetzlich nicht zur Durchführung von Risikowarnungen erforderlich sind, können diese Produkte theoretisch die gleichen Risiken wie die oben genannten für die synthetische Hormontherapie darstellen. Bisher gab es jedoch keine direkten Sicherheitsversuche mit CHT im Vergleich zu synthetischen Hormonen.,10
Es gibt drei Arten von Östrogenen, die eine Frau als Teil eines zusammengesetzten Hormonersatzprogramms erhalten kann: Östron (E1), Estradiol (E2) und Estriol (E3) mit jeweils unterschiedlicher Potenz (E2 > E1 > E3).9 Weil sie um denselben Rezeptor wetteifern, wirken diese Östrogene als kompetitive Inhibitoren, was zu einer verminderten Wirksamkeit führt, wenn sie nicht richtig ausgeglichen sind.,11 Folglich entwickelten Befürworter von CHT Biest (E2 + E3 in einer 20/80-Formulierung) und Triest (E1 + E2 + E3 in einer 10/10/80-Formulierung), um die physiologische Potenz zu maximieren, aber es gibt derzeit keine Beweise für die Behauptung, dass diese Formulierungen in diesen Verhältnissen einen Sicherheitsvorteil im Vergleich zur synthetischen Hormontherapie bieten.11
Obwohl die CHT insgesamt unzureichend untersucht und nicht reguliert wurde, wurde Bijuva im Oktober 2018 auf der Grundlage der Ergebnisse der REPLENISH-Studie zur ersten von der FDA zugelassenen bioidentischen Kombination 17-Beta-Estradiol-Progesteron-Formulierung., REPLENISH, eine randomisierte, doppelblinde, placebokontrollierte, multizentrische Phase-III-Studie, untersuchte die Wirksamkeit, Endometriumsicherheit und Gesamtsicherheit von vier verschiedenen Dosierungen einer einzelnen 17-Beta-Estradiol-Progesteron-Kapsel für mittelschwere bis schwere vasomotorische Symptome bei postmenopausalen Frauen.12 Der primäre Sicherheitsendpunkt war die Inzidenz von Endometriumhyperplasie nach 12 Monaten. Nach 12 Monaten wurden für keine der Estradiol-Progesteron-Dosierungsformulierungen Fälle von Endometriumhyperplasie beobachtet.,12 Nach 12 Wochen zeigte die Estradiol 1 mg–Progesteron 100 mg-Formulierung die größte statistisch signifikante Verringerung der Häufigkeit und Schwere vasomotorischer Symptome im Vergleich zu Placebo unter Beibehaltung der primären Sicherheitsendpunktstandards.12 Wie bereits erwähnt, gab es jedoch keine Studien, in denen die Sicherheit synthetischer Hormone mit bioidentischen Hormonformulierungen verglichen wurde, so dass theoretisch die Risiken bestehen bleiben.,
Schlussfolgerung
Basierend auf der REPLENISH-Studie haben prä -, peri-und postmenopausale Frauen jetzt eine standardisierte, regulierte, bioidentische und von der FDA zugelassene Behandlung für vasomotorische Symptome. Zukünftige Studien sind erforderlich, um das Sicherheitsprofil von 17-Beta-Estradiol und CHT vollständig abzugrenzen. Apotheker sollten jede orale Hormonformulierung für die kürzeste mögliche Dauer empfehlen., Wenn CHT ausgewählt wird, sollten Apotheker außerdem sicherstellen, dass ihre Patienten wissen, was CHT ist und wie es sich von synthetischen Hormonen unterscheidet, und gleichzeitig offen über die Vorteile und Risiken einer Hormonersatztherapie sprechen.
1. Martin KA, Manson JE. Annäherung an den Patienten mit Menopausensymptomen. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Dauer der menopausalen vasomotorischen Symptome über den Wechseljahrsübergang. JAMA Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Ärsche CL, et al., Verschärft bioidentische Hormone in der Endokrinologie Praxis: eine Endocrine Society scientific statement. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Östrogene und Gestagene: Hintergrund und Anamnese, Trends in der Anwendung sowie Richtlinien und Therapien, die von der US Food and Drug Administration genehmigt wurden. Am J Med. 2005;118(suppl 12B):64-73.
5. Schreibgruppe für die PEPI-Studie. Auswirkungen der Hormonersatztherapie auf die Endometriumhistologie bei postmenopausalen Frauen. Die postmenopausale Östrogen / Gestagen-Interventionen (PEPI) – Studie. JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. Drei Fälle von Endometriumkarzinom im Zusammenhang mit einer“ bioidentischen “ Hormonersatztherapie. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Risiken und Nutzen von Östrogen plus Gestagen bei gesunden Frauen nach der Menopause: Hauptergebnisse der randomisierten kontrollierten Studie der Women ‚ s Health Initiative. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. Compounded bioidentical Hormon therapy:Identifizierung von Trends und Wissenslücken bei US-Frauen. Menopause. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Missverständnisse und Bedenken hinsichtlich bioidentischer Hormone, die für die individuell zusammengesetzte Hormontherapie verwendet werden. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (Estradiol und Progesteron) Packungsbeilage. Boca Raton, FL: TherapeuticsMD, Inc; November 2019.
11. Kuhl H. Pharmakologie von Östrogenen und Gestagenen: Einfluss verschiedener Verabreichungswege. Klimakterium. 2005;8(suppl 1):3-63.
12. Lobo RA, Archer DF, Kagan R, et al. Eine orale 17beta-Estradiol-Progesteron-Kapsel zur Behandlung vasomotorischer Symptome bei Frauen nach der Menopause: eine randomisierte kontrollierte Studie. Geburtshelfer Gynäkologe., 2018;132(1):161-170.
Der Inhalt dieses Artikels dient nur zu Informationszwecken. Der Inhalt soll keine professionelle Beratung ersetzen. Das Vertrauen in die in diesem Artikel bereitgestellten Informationen erfolgt ausschließlich auf eigenes Risiko.