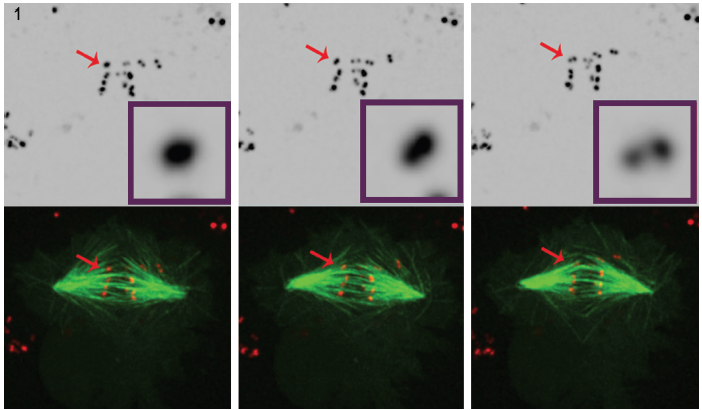
Figur 1. Tre valda stillbilder från en film av POLOUTARMADE celler visar tydligt att intensiv centromere/kinetochore-signal (röd) med tiden löser sig i ett par prickar, vilket visar att kromosomer är synteliskt fästa vid spindelmikrotubuler (grön). 4D fluorescensmikroskopidatauppsamlades var 30: e sekund med 0.,5 mm z-steg som täcker hela cellvolymen med hjälp av en 100°, 1.4 NA plan-apokromatiskt mål vid 25 ° C med Andors Revolution spinning disk confocal unit och iXon EMCCD kamera, båda drivs av Andor IQ live-cell imaging programvara.
mitotisk celldelning bygger på cellernas förmåga att korrekt distribuera systerkromatider till formande celler. För att på ett tillförlitligt sätt utföra funktionscellerna använder interna redigeringsmekanismer för att korrigera felaktiga kromosom – / spindelfiberfästen., Parade kinetochores är vanligtvis inriktade för att korrekt fästa spindelfibrer och segregera kromatin, men felaktiga och feljusterade kinetochores resulterar. Celler innehåller specialiserade redigeringsmekanismer för att förhindra och korrigera dessa feljusterade kinetochore-par, även om den exakta mekanismen inte är väl förstådd 1,2 ., Det är postuleras av Tatiana Moutinho-Santos vid Universidade do Porto, Portugal Instituto de Biologia Molekylär e Celular (IBMC) att förekomsten av POLO proteinkinas som är nödvändigt för att främja kromosom bi-läggning (kallas amphitelic arrangemang) och därigenom bevara god kinetochore anpassning.
för Att bättre förstå sin roll i regleringen av kinetochore utveckling, Dr Moutinho dos Santos studerade utarmat Drosophila POLO kinas inom levande celler för att styrka POLO: s inblandning i-redigering funktioner som krävs för att upprätthålla amphitelic kinetochore arrangemang., I detta fall studerades syntetiskt arrangemang (syster kinetochores fäst vid mikrotubuler som härrör från samma spindel). Timelapse analys av mitos utfördes på Drosophila S2 celler stabilt uttrycka CID-mCherry för visualisering av centromeres, och GFP-en-tubulin för mikrotubuli. Visualisering av kinetochores kräver på grund av sin lilla storlek, låg fluorescerande signal och kort utseende under celldelning. Konfokal fluorescensmikroskopi används ofta för att avbilda kinetochores, men även i denna miljö är visualisering fortfarande svår., Kinetochorerna är mycket små (300 nm)3, nära ljusmikroskopets laterala upplösningsförmåga och överstiger mikroskopets axiella upplösningsförmåga. Dessutom utgör avbildningsfluorescerande markörer inom levande celler potentiella fototoxiska och fotoblekande effekter. Intensiv laserbelysning kan skapa fototoxicitetsproblem, särskilt skadliga för levande, delande celler.
Andors Revolution XD spinning disk confocal microscopy används för att övervinna Dr.Moutinho dos Santo unika utmaning i samband med observation av kinetochores., I detta fall måste fyra separata faktorer samtidigt adresseras för att på ett adekvat sätt visualisera de dynamiska cellulära processerna:
- förvärvshastighet
- rumslig och tidsmässig upplösningsförmåga
- förmågan att detektera mycket låga fluorescensintensitetsnivåer
- hantering av tillgänglig fluorescenssignal
dessa teman för rumslig, temporal och intensitetsupplösning återkommer ofta med fluorescensmikroskopi och är ofta i strid med experiment som involverar observation av cellens livskraft., Till exempel genererar långa kameraexponeringar och förlängda perioder med högintensiv belysning de fototoxiska effekter som skadar eller förstör levande celler. Samtidigt kräver lätt märkta mikrostrukturer längre exponering för att visualisera men kan påverkas negativt av fotoblekning. Att sammanställa frågan är behovet av att kombinera traditionella tredimensionella data med tiden. Slutligen är det fortfarande nödvändigt att urskilja signal från bakgrundsbrus och outof – focus dis.
förvärvshastigheten är av särskild betydelse för Dr.Mountinho dos Santos., Kontroll S2-celler uppvisar en delningscykel på cirka 30 minuter. POLO utarmade S2-celler som användes i hennes experiment visade emellertid en arresterad period över åtta timmar. Inspelning POLO utarmat cell division kräver insamling av mellan 7,200 och 12,000 bilduppsättningar (två fluorokromer avbildas var trettio sekunder för en till fem timmar, förvärvats vid 0,5 mikron axiella steg på upp till 20 steg för axiell kinetochore upplösning)., Konventionell fluorescensmikroskopi och laserbelysning tillåter varken de mjuka belysningskraven som är nödvändiga eller förvärvshastigheten för att slutföra denna tidskänsliga uppgift. Till exempel kräver laser rastering i traditionell konfokalmikroskopi längre tidsperioder för att samla in signal från provet. Spinning disk confocal system används för att övervinna dessa traditionella hinder och att avslöja nya insikter i molekylär kinetochore redigeringsteknik.,
jämfört med konventionella widefields fluorescenssystem är den rumsliga upplösningen hos en spinnskivkonfokal överlägsen i både laterala (x och y) och axiella (z) dimensioner. Genom konstant skanning av pinhole-matrisen kan prover ses i realtid vid hög kontrast, vilket ger tydliga bilder vid diffraktionsgränserna för mikroskopets optik. Detta möjliggör 3D-visualisering och förståelse av det dynamiska kinetochore-beteendet i förhållande till spindelns mikrotubuli., Kinetochore och centromere lateral upplösning av 300nm och spindelfiberupplösning på 300-500 nm rapporterades och beskrivs i Figur A.
Intensitetsupplösning
visualisering av fluorescently märkta kinetochores associerade med varje centromere ställer ytterligare krav på förvärvssystemet. De centromerer och kinetochores som studeras är främst synliga endast under celldelning interfas. När cellerna passerar genom profas har centromererna redan löst sig i Drosophilas typiska tolv kromosompar., Hantera tillgängliga ljus budget under långa förvärv kräver mild belysning och hög upplösning kan genom spinning disk tekniker. Öppningarna i spinnskivans enhet ger dessa fördelar. Eftersom ljus exciterar fluorophorer endast när en bländare är närvarande, minimeras fototoxiska effekter. Medan kontraintuitive, indikerar en minskad ljusbudget inte svaga, svåra att upptäcka objekt. Intensitetsupplösningen ökas genom att spinnskivan utesluts från urfokussignal och efterföljande signalförstärkning genom en EMCCD – kameraarkitektur., Detta skapar den nya möjligheten att generera högre kontrastbilder som avslöjar utveckling och inriktning av punktat objekt som kinetochores.
slutsatser
användningen av spinning disk teknik i Dr.Mountinho dos Santos live cell ansökan ledde till en viktig observation. I avsaknad av POLOKINAS visade sig Drosophila-celler sakna de korrigerande mekanismer som är nödvändiga för att upprätthålla amfitelisk kromosomarrangemang., Närvaron av POLO visades ge rätt miljö för korrekt centromere arkitektur, samtidigt som man säkerställer korrekt kromosom bi-orientering. Odlade Drosophila-celler som genomgår mitos i frånvaro av POLOKINAS-kromosomer fäster vid spindelfibrer med syntetisk orientering, dvs med systerkinetochores fäst vid mikrotubuli som kommer från en enda spindelstolpe.
denna slutsats drogs genom noggrann analys av 4D fluorescensmikroskopi i celler som uttrycker fluorescent märkt centromere/ kinetochore markör och mikrotubuli. (Figur 1).