US Pharm. 2020;45(9):27-29.
sammanfattning: eftersom syntetiska hormoner först kombinerades på 1940-talet har hormonersättningsterapi använts i stor utsträckning av kvinnor som upplever oönskade menopausala symptom. Efterföljande forskning ledde till upptäckter av flera negativa effekter i samband med användning av hormonbehandling, gnistrande diskussioner om riskerna mot fördelarna med hormonbehandling., På grund av de risker som är förknippade med kommersiella preparat har kompounded hormone therapy (CHT) blivit mer framträdande, eftersom det har blivit känt som ett biologiskt ekvivalent alternativ till syntetiska hormoner. Men på grund av minimal eller ingen FDA-övervakning i det sammansatta riket i allmänhet kan CHT inte vara så säkert som det har annonserats. I 2018, baserat på gynnsamma försöksresultat, blev Bijuva den första FDA-godkända bioidentiska kombinationen 17-beta estradiol-progesteronformulering.,
i årtionden har kvinnor vänt sig till hormonersättningsterapi för att behandla negativa vasomotoriska symptom i samband med klimakteriet, såsom heta blinkar och nattsvett. Kvinnor kan spendera upp till en tredjedel av sina liv i ett hormonbristande tillstånd, vilket ytterligare bidrar till sådana biverkningar som humörförändringar, ökad risk för osteoporos och minskad libido. Systemisk östrogen är den mest effektiva behandlingen för vasomotoriska symptom, medan genitourära symptom i samband med klimakteriet bör behandlas med lågdos topisk östrogen.,1 observationsstudien av kvinnors hälsa över hela landet fann att kvinnor upplever vasomotoriska symptom i genomsnitt 7,4 år efter klimakteriet.2 de flesta kliniker rekommenderar dock att behandlingen varar längre än 5 år efter klimakteriet och rekommenderar starkt att man undviker hormonbehandling helt och hållet hos kvinnor äldre än 60 år.1 läkaren bör noggrant väga de risker och fördelar som är förknippade med syntetiska och sammansatta hormoner samtidigt som man tänker på det primära målet att förbättra patientens livskvalitet.,
bioidentiska hormoner
bioidentiska hormoner, såsom östrogener, progestiner och androgener, är föreningar som framställs enligt USP Kapitel<795> icke-standardiserade Kompounderingsstandarder. Dessa hormoner kan förvärras i en mängd olika doser och doseringsformer, vilket skapar många alternativ för kvinnor som är intresserade av sammansatt hormonbehandling (CHT)., Sammansatta formuleringar genomgår inte de strikta tillverknings-och renhetsstandarderna som deras FDA-godkända motsvarigheter gör.trots denna oreglerade miljö är CHT dock mycket populär bland patienter som söker mer ”personlig” medicin.
det endokrina samhället har definierat sammansatta bioidentiska hormoner som ”föreningar som har exakt samma kemiska och molekylära struktur som hormoner som produceras i människokroppen.,”3 FDA hävdar att termen bioidentiskt hormon är rent en marknadsföringsstrategi, eftersom det inte finns någon vetenskaplig grund för en implicit fördel eller riskreduktion för CHT över FDA-godkänd syntetisk hormonbehandling.3
syntetisk hormonbehandling
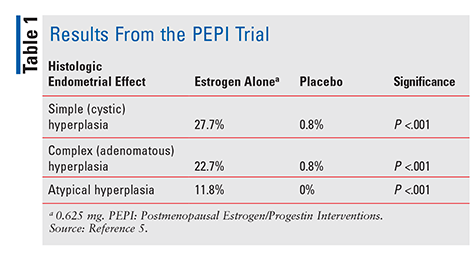
FDA godkände dietylstilbestrol 1941 och konjugerade equine estrogener (CEE) 1942 för att behandla menopausala symptom.4 Från och med 1960-talet ökade östrogenförsäljningen fram till 1975, när rapporter visade att östrogenanvändning kan vara förknippad med en ökad risk för endometrial cancer.,4 dessa rapporter ignorerades emellertid i stor utsträckning, och östrogenanvändningen fortsatte. Inte förrän 1996, när postmenopausala östrogen/Progestininterventioner (PEPI) – studien publicerades, började vårdgivare verkligen förstå de potentiella negativa effekterna i samband med östrogenbehandling. PEPI var en 3-årig randomiserad, placebokontrollerad, dubbelblind, multicenterstudie som undersökte de histologiska endometriella effekterna av terapi med syntetiskt oupplöst östrogen jämfört med tre olika regimer av syntetiskt östrogen plus progestin.,5
i Pepi-studien utvecklade signifikant fler försökspersoner som enbart fick östrogen enkel, komplex eller atypisk endometriehyperplasi jämfört med försökspersoner som fick placebo (tabell 1). Även om de exakta procentsatserna inte specificerades, var hyperplasifrekvensen hos patienter som fick en av de tre östrogen plus-progestinregimerna likartad med den hos patienter som fick placebo.5 Sammanfattningsvis administrering av östrogen ensamt i en dos av 0.,625 mg per dag ledde till en signifikant ökad förekomst av endometrial hyperplasi, medan kombinationen av CEE med progestin skyddade endometrium från överväxt till en avsevärd grad.5 på grund av denna beprövade endometrial-cancerrisk ges progestin alltid i kombination med östrogen hos kvinnor med intakt livmoder. Ytterligare bekräftar denna risk, en 2007 fall serie beskrev tre kvinnor som använde CHT innehållande subterapeutiska doser av progestin och senare utvecklade endometrial cancer.,6
Pepi-studien, tillsammans med resultat på 16 068 postmenopausala kvinnor från Women ’ s Health Initiative (WHI) som publicerades 2002, belyste de allvarliga farhågor som uppstod under 1970-talet7.även om Pepi-studien inte visade någon ökad risk för hyperplasi med kombinationsprodukten, fann WHI signifikant ökade risker i samband med användning av syntetiska hormoner, såsom kardiovaskulär mortalitet.sjukdom, stroke, tromboemboliska händelser och bröstcancer.,7 det fanns en 80% ökad risk för hjärt-kärlsjukdom vid 1 år efter avbrytande av kombinationen cee / medroxiprogesteronacetatbehandling och en 37% ökad risk för ischemisk stroke under interventionsfasen med kombinationsbehandling. Risken för bröstcancer ökade också signifikant (24%) under intervention. Användning av östrogen-plus-progestin gav vissa fördelar, med patienter som noterade en minskad förekomst av vaginal atrofi, reducerade vasomotoriska symtom som heta blinkar och nattsvett och en 38% minskad risk för kolorektal cancer under behandling med kombinationsbehandling.,På grund av den ökade risken för bröstcancer och tromboemboliska händelser avbröts dock studien tidigt.
sammansatt hormonbehandling
de risker som diskuterades ovan banade vägen för CHT-förespråkning eftersom man trodde att skräddarsy eller anpassa CHT till den enskilda patienten skulle maximera nyttan och minimera risken. Hävdar att CHT var säkrare och biologiskt vänligare blev mer framträdande, och användningen ökade., Pinkerton och Santoro använde två olika undersökningar—Harris och Rose-för att bedöma patienternas kunskap om CHT och kvantifiera användningen av CHT mot FDA-godkänd hormonbehandling.8 resultaten av Harris-undersökningen visade att 86% av kvinnorna i åldern 40 till 65 år var omedvetna om att CHT inte var FDA-godkänd, och extrapolerade resultat från Rose-undersökningen föreslog att upp till 2,5 miljoner kvinnor äldre än 40 år årligen kan använda CHT.Data från båda undersökningarna visade att en läkare eller farmaceut hade rekommenderat CHT., Dessa resultat tyder på att det finns en möjlighet för leverantörer att se till att patienterna informeras om den produkt de får, inklusive alla möjliga risker som är förknippade med hormonbehandling, och för att sammanställa apotekare för att säkerställa att de levererar en terapeutiskt ren produkt som patienter kan lita på.
eftersom FDA inte är ansvarig för standardisering av sammansatta produkter, faller reglering ofta till statliga apotekstyrelser., Dessa styrelser har vanligtvis inte resurser att genomföra regelbundna inspektioner av sammansatta apotek, och FDA ingriper endast när ett klagomål görs.9 även om sammansatta formuleringar inte är juridiskt skyldiga att bära riskvarningar, kan dessa produkter teoretiskt utgöra samma risker som de som nämns ovan för syntetisk hormonbehandling. Hittills har det dock inte förekommit några säkerhetsstudier från huvud till huvud av CHT kontra syntetiska hormoner.,10
det finns tre typer av östrogener som en kvinna kan få som en del av en sammansatt hormonersättningsplan: östron (E1), östradiol (E2) och östriol (E3), som var och en har en varierande grad av potens (E2 > e1 > E3).9 eftersom de vie för samma receptor, dessa östrogener fungerar som kompetitiva hämmare, vilket resulterar i minskad effekt om inte korrekt balanserad.,11 följaktligen utvecklade förespråkare av CHT Biest (E2 + E3 i en 20/80-formulering) och Triest (E1 + E2 + E3 i en 10/10/80-formulering) för att maximera fysiologisk styrka, men det finns för närvarande inga bevis för att hävda att dessa formuleringar i dessa förhållanden ger någon säkerhetsförmån jämfört med syntetisk hormonbehandling.11
Även om hela CHT har studerats otillräckligt och oreglerat, i oktober 2018, baserat på resultaten från REPLENISH-studien, blev Bijuva den första FDA-godkända bioidentiska kombinationen 17-beta-östradiol-progesteronformulering., REPLENISH, en fas III, randomiserad, dubbelblind, placebokontrollerad multicenterstudie, undersökte effekt, endometrial säkerhet och övergripande säkerhet av fyra olika doser av en enda 17-beta östradiol-progesteronkapsel för måttliga till svåra vasomotoriska symptom hos postmenopausala kvinnor.Primär endpoint för säkerhet var incidensen av endometriehyperplasi vid 12 månader. Vid 12 månader observerades inga fall av endometrial hyperplasi för någon av doseringsformuleringarna för östradiol-progesteron.,12 vid 12 veckor visade östradiol 1 mg–progesteron 100 mg-formuleringen den största statistiskt signifikanta minskningen av vasomotorisk symtomfrekvens och svårighetsgrad jämfört med placebo samtidigt som primära endpoint-standarder upprätthölls.12 men som tidigare nämnts har det inte gjorts några försök att jämföra säkerheten hos syntetiska hormoner mot bioidentiska hormonformuleringar, så teoretiskt kvarstår riskerna.,
slutsats
baserat på REPLENISH trial, pre-, peri-och postmenopausala kvinnor har nu en standardiserad, reglerad, bioidentisk, FDA-godkänd behandling för vasomotoriska symptom. Framtida försök behövs för att fullständigt avgränsa säkerhetsprofilen för 17-beta-östradiol och CHT. Apotekare bör rekommendera någon oral hormonformulering under kortast möjliga tid., Dessutom, om CHT väljs, apotekare bör se till att deras patienter vet vad CHT är och hur det skiljer sig från syntetiska hormoner samtidigt ha en uppriktig konversation om fördelarna och riskerna med hormonersättningsterapi.
1. Martin KA, Manson JE. Tillvägagångssätt för patienten med menopausala symptom. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Varaktighet av menopausala vasomotoriska symptom över klimakteriet övergången. JAMA praktikant Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Rumpor CL, et al., Compounded bioidentiska hormoner i endokrinologi praktiken: ett endokrina samhället vetenskapliga uttalande. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Östrogener och progestiner: bakgrund och historia, trender i användning och riktlinjer och regimer godkända av US Food and Drug Administration. Är J Med. 2005;118(suppl 12B):64-73.
5. Skrivgrupp för Pepi-rättegången. Effekter av hormonersättningsterapi på endometrial histologi hos postmenopausala kvinnor. Den postmenopausala östrogen/Progestin interventioner (PEPI) studie. JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. tre fall av endometrial cancer i samband med” bioidentisk ” hormonersättningsterapi. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Risker och fördelar med östrogen plus progestin hos friska postmenopausala kvinnor: huvudresultat från kvinnors hälsoinitiativ randomiserad kontrollerad studie. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. Compounded bioidentical hormone therapy: identifiera användningstrender och kunskapsluckor bland amerikanska kvinnor. Klimakterium. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Missuppfattning och oro för bioidentiska hormoner som används för skräddarsydd hormonbehandling. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (östradiol och progesteron) paketinsats. Boca Raton, FL: TherapeuticsMD, Inc. November 2019.
11. Kuhl H. farmakologi av östrogener och progestogener: påverkan av olika administreringsvägar. Klimakteriet. 2005;8(suppl 1):3-63.
12. Lobo RA, Archer DF, Kagan R, et al. En 17beta-östradiol-progesteron oral kapsel för vasomotoriska symptom hos postmenopausala kvinnor: En randomiserad kontrollerad studie. Obstett Gynekol., 2018;132(1):161-170.
innehållet i denna artikel är endast i informationssyfte. Innehållet är inte avsett att ersätta professionell rådgivning. Beroende av någon information som anges i denna artikel är enbart på egen risk.