långt svar. För det första måste en skillnad göras mellan polariteten hos en bindning och polariteten hos en molekyl (eller förening).
Bondpolaritet avser en separation av elektrisk laddning som härrör från en skillnad i elektronegativitet mellan de två atomer eller grupper som binder samman.,
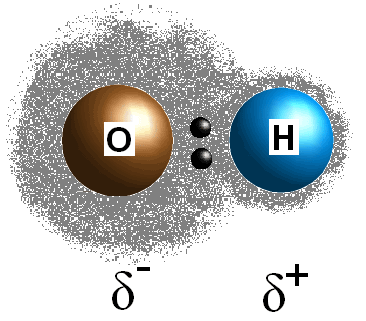
denna skillnad i elektronegativitetsvärden mellan de två atomerna gör att bondens elektroner delas ojämnt, vilket skapar en postiv laddning (#delta^+#) på den mindre elektronegativa atomen och en partiell negativ laddning (#delta^(-)#) på den mer elektronegativa atomen. Polariteten hos en bindning kan bestämmas med enbart elektronegativitetsvärdena för de två beståndsdelarna atomer.
om bindningen mellan de två atomerna i inte polära, d.v.s. skillnaden i elektronegativitet mellan de två atomerna är mindre än 0.,5, då blir din molekyl icke-polär. Om bindningen verkligen är polär kan du fortsätta att försöka bestämma molekylens polaritet.
en molekyls geometri är en viktig faktor för att bestämma en molekyls polaritet. Dessa ovan nämnda partiella avgifter ger upphov till ett obligationsdipol ögonblick, #mu#.
om orienteringarna av dessa bindningsdipolmoment avbryter varandra, sägs molekylen vara icke-polär. Om de inte gör det, har du att göra med en polär molekyl.,
några exempel där bond dipol stunder avbryter varandra, vilket resulterar i en icke-polär molekyl:
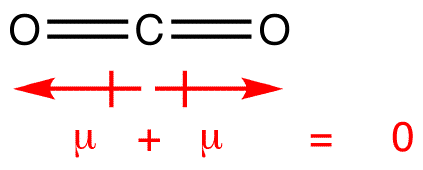
dipol stunder dras med pilen pekar på den mer elektronegativa atomen och plussidan på den mindre elektronegativa atomen. Observera att för #CO_2#, som har två polära bindningar, är det totala dipolmomentet noll, eftersom dessa två pilar avbryter varandra. Detta resulterar i en icke-polär molekyl., Detsamma kan sägas om #bf_3#:
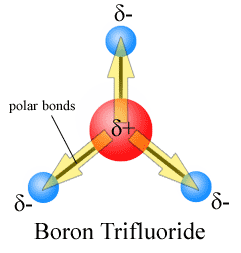
de tre dipolmomenten avbryter varandra som ett resultat av det symmetriska arrangemanget av bindningarna (se mer om vektortillägg).
ett assymetriskt arrangemang av partiella laddningar resulterar i en polär molekyl, som du kan se för vatten:
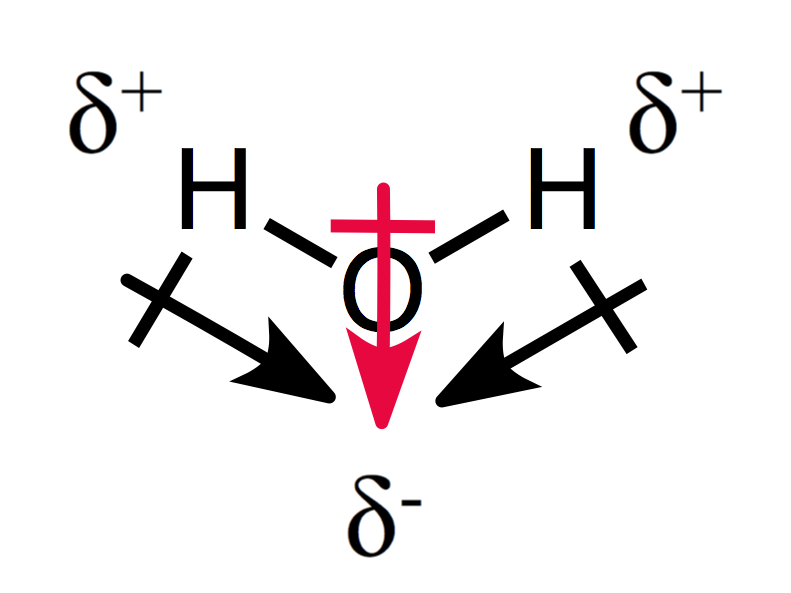
de två dipolmomenten lägger till varandra och skapar ett övergripande dipolmoment och därmed en polär molekyl.,
som en slutsats, för att förutsäga en molekyls polaritet, måste du vara bekant med Lewis strukturer, elektronegativitet, VSEPR teori och bond polaritet.