inlärningsmål
i slutet av detta avsnitt kommer du att kunna:
- beskriva hur elektroner upptäcktes.
- förklara Millikan oljedroppsexperimentet.
- beskriv Rutherfords guldfolie experiment.
- beskriv Rutherfords planetariska modell av atomen.
precis som atomer är en understruktur av materia, elektroner och kärnor är understrukturer av atomen., De experiment som användes för att upptäcka elektroner och kärnor avslöjar några av de grundläggande egenskaperna hos atomer och kan lätt förstås med hjälp av idéer som elektrostatisk och magnetisk kraft, som redan omfattas av tidigare kapitel.
laddningar och elektromagnetiska krafter
i tidigare diskussioner har vi noterat att positiv laddning är förknippad med kärnor och negativ laddning med elektroner. Vi har också täckt många aspekter av de elektriska och magnetiska krafter som påverkar laddningar., Vi kommer nu att undersöka upptäckten av elektronen och kärnan som understrukturer av atomen och undersöka deras bidrag till egenskaperna hos atomer.
elektronen

Figur 1. Ett gasurladdningsrör lyser när en hög spänning appliceras på den. Elektroner som avges från katoden accelereras mot anoden; de exciterar atomer och molekyler i gasen, som lyser som svar., En gång kallade Geissler-rör och senare Crookes-rör, är de nu kända som katodstrålerör (CRT) och finns i äldre TV-apparater, datorskärmar och röntgenmaskiner. När ett magnetfält appliceras böjer strålen i den riktning som förväntas för negativ laddning. (kredit: Paul Downey, Flickr)
gasurladdningsrör, såsom de som visas i Figur 1, består av ett evakuerat glasrör innehållande två metallelektroder och en sällsynt gas. När en hög spänning appliceras på elektroderna lyser gasen. Dessa rör var föregångarna till dagens neonljus., De studerades först allvarligt av Heinrich Geissler, en tysk uppfinnare och glasblåsare, med början på 1860-talet. den engelska forskaren William Crookes fortsatte bland annat att studera vad som under en tid kallades Krookesrör, där elektroner befrias från atomer och molekyler i den sällsynta gasen inuti röret och accelereras från katoden (negativ) till anoden (positiv) av den höga potentialen., Dessa ”katodstrålar” kolliderar med gasatomerna och molekylerna och exciterar dem, vilket resulterar i utsläpp av elektromagnetisk (EM) strålning som gör elektronernas väg synlig som en stråle som sprider sig och bleknar när den rör sig bort från katoden.
gasurladdningsrör idag kallas oftast katodstrålerör, eftersom strålarna härstammar från katoden. Crookes visade att elektronerna bär fart (de kan göra en liten paddel hjul rotera)., Han fann också att deras normalt raka väg böjs av en magnet i den riktning som förväntas för en negativ laddning som rör sig bort från katoden. Dessa var de första direkta indikationerna på elektroner och deras laddning.

Figur 2. J. J. Thomson (kredit: www.firstworldwar.com, via Wikimedia Commons)
den engelska fysikern J. J. Thomson (1856-1940) förbättrade och utvidgade omfattningen av experiment med gasurladdningsrör. (Se Figur 2 och 3.,) Han verifierade den negativa laddningen av katodstrålarna med både magnetiska och elektriska fält. Dessutom samlade han strålarna i en metallkopp och fann ett överskott av negativ laddning. Thomson kunde också mäta förhållandet mellan elektronens laddning och dess massa, \ frac{q_e}{m_e}— \ – ett viktigt steg för att hitta de faktiska värdena för både qe och me. Figur 4 visar ett katodstrålerör, som producerar en smal stråle av elektroner som passerar genom laddningsplattor anslutna till en högspänningsförsörjning., Ett elektriskt fält e produceras mellan laddplattorna och katodstråleröret placeras mellan polerna på en magnet så att det elektriska fältet E är vinkelrätt mot magnetfältet B i magneten. Dessa fält, som är vinkelräta mot varandra, producerar motsatta krafter på elektronerna. Som diskuterats för masspektrometrar i fler tillämpningar av Magnetism, om nätkraften på grund av fälten försvinner, är hastigheten hos den laddade partikeln v = \frac{e}{b}\\., På detta sätt bestämde Thomson elektronernas hastighet och flyttade sedan strålen upp och ner genom att justera det elektriska fältet.

Figur 3. Diagram över Thomsons CRT. (credit: Kurzon, Wikimedia Commons)

Figur 4. Denna schematiska visar elektronstrålen i en CRT som passerar genom korsade elektriska och magnetiska fält och orsakar fosfor att glöda när slående änden av röret.
samla termer, vi har \frac{q_e}{m_e}=\frac{a}{e}\\.,
vad är så viktigt om \ frac{q_e}{m_e}\\, förhållandet mellan elektronens laddning och dess massa? Det värde som erhålls
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (elektron)}\\
Detta är ett stort antal, som Thomson insåg, och det innebär att elektronen har en mycket liten massa. Det var känt från elektroplätering att cirka 108 C/kg behövs för att platta ett material, en faktor på ca 1000 mindre än laddningen per kilo elektroner., Thomson fortsatte med att göra samma experiment för positivt laddade vätejoner (nu kända för att vara nakna protoner) och hittade en laddning per kilo ca 1000 gånger mindre än för elektronen, vilket innebär att proton är ca 1000 gånger mer massiv än elektronen. Idag vet vi mer exakt att
\displaystyle\frac{q_p}{M_P}=9.58\times10^{7}\text{ C/kg (proton)}\\,
där qp är laddningen av proton och mp är dess massa. Detta förhållande (till fyra signifikanta siffror) är 1836 gånger mindre laddning per kilo än för elektronen., Eftersom laddningarna av elektroner och protoner är lika stora innebär detta mp = 1836me.
Thomson utförde en mängd olika experiment med olika gaser i urladdningsrör och använde andra metoder, såsom den fotoelektriska effekten, för att frigöra elektroner från atomer. Han hittade alltid samma egenskaper för elektronen, vilket bevisar att den är en oberoende partikel. För sitt arbete, de viktiga bitar som han började publicera 1897, tilldelades Thomson 1906 Nobelpriset i fysik., I efterhand är det svårt att uppskatta hur förvånande det var att finna att atomen har en understruktur. Thomson själv sa: ”det var först när jag var övertygad om att experimentet inte lämnade någon flykt från det att jag publicerade min tro på förekomsten av kroppar mindre än atomer.”
Thomson försökte mäta laddningen av enskilda elektroner, men hans metod kunde bestämma sin laddning endast till den storleksordning som förväntas.
sedan Faradays experiment med elektroplätering på 1830-talet hade det varit känt att cirka 100 000 C per mol behövdes för att platta enstaka joniserade joner., Dividera detta med antalet joner per mol (det vill säga med Avogadros nummer), vilket var ungefär känt, beräknades laddningen per Jon vara ca 1,6 × 10-19 c, nära det faktiska värdet.

Figur 5. Robert Millikan (credit): en Okänd Författare, via Wikimedia Commons)
En Amerikansk fysiker, Robert Millikan (1868-1953) (se Figur 5), bestämde sig för att förbättra Thomson experiment för mätning av qe och blev så småningom tvungen att prova en annan metod, som nu är ett klassiskt experiment som utförs av studenter., Millikan oljedroppsexperimentet visas i Figur 6.
i Millikanoljedroppsexperimentet sprutas fina droppar olja från en finfördelare. Några av dessa laddas av processen och kan sedan suspenderas mellan metallplattor med en spänning mellan plattorna. I denna situation balanseras vikten av droppen av den elektriska kraften:
m dropg = qe e

Figur 6., Millikan oil drop experiment producerade den första exakta direkta mätningen av laddningen på elektroner, en av de mest grundläggande konstanterna i naturen. Fina droppar olja laddas vid sprutning. Deras rörelse observeras mellan metallplattor med en potential som appliceras för att motsätta sig gravitationskraften. Balansen mellan gravitationella och elektriska krafter möjliggör beräkning av laddningen på en droppe. Laddningen befanns kvantifieras i enheter av -1.6 × 10-19 C, vilket direkt bestämmer laddningen av överskottet och saknade elektroner på oljedropparna.,
det elektriska fältet produceras av den applicerade spänningen, därför E=\frac{v}{d}\\, och V justeras för att bara balansera droppens vikt. Dropparna kan ses som punkter av reflekterat ljus med hjälp av ett mikroskop, men de är för små för att direkt mäta deras storlek och massa. Droppens massa bestäms genom att observera hur snabbt det faller när spänningen är avstängd. Eftersom luftmotståndet är mycket signifikant för dessa submikroskopiska droppar faller de mer massiva dropparna snabbare än de mindre massiva, och sofistikerade sedimenteringsberäkningarna kan avslöja deras massa., Olja används snarare än vatten, eftersom det inte lätt avdunstar, och så är massan nästan konstant. När massan av droppen är känd, laddningen av elektronen ges genom att omarrangera den föregående ekvationen:
\displaystyle{q}=\frac{m_{\text{drop}}g}{e}=\frac{m_{\text{drop}}gd}{v}\\\,
där d är separationen av plattorna och V är spänningen som håller droppen orörlig. (Samma droppe kan observeras i flera timmar för att se att det verkligen är rörlöst.,) Av 1913 Millikan hade mätt laddningen av elektronen qe till en noggrannhet av 1%, och han förbättrade detta med en faktor 10 inom några år till ett värde av -1.60 × 10-19 C. han observerade också att alla laddningar var multiplar av den grundläggande elektronladdningen och att plötsliga förändringar kunde uppstå där elektroner tillsattes eller avlägsnades från dropparna. För denna mycket grundläggande direkta mätning av qe och för sina studier av den fotoelektriska effekten tilldelades Millikan 1923 Nobelpriset i fysik.,
med den kända elektronens laddning och det kända förhållandet mellan laddning och massa kan elektronens massa beräknas. Det är
\displaystyle{M}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\\
ersätta kända värden ger
\displaystyle{M}_e=\frac{-1.60\times10^{-19}\Text{ C}}{-1.76\times10^{11}\text{ c/kg}}\ \
eller ME = 9.11 × 10-31 kg (elektronens massa), där avrundningsfel har korrigerats., Elektronens massa har verifierats i många efterföljande experiment och är nu känd för en noggrannhet av bättre än en del i en miljon. Det är en otroligt liten massa och förblir den minsta kända massan av någon partikel som har massa. (Vissa partiklar, som fotoner, är masslösa och kan inte vila, men färdas med ljusets hastighet.) En liknande beräkning ger massorna av andra partiklar, inklusive proton. Till tre siffror är protonens massa nu känd för att vara mp = 1,67 × 10-27 kg (protons massa), vilket är nästan identiskt med massan av en väteatom., Vad Thomson och Millikan hade gjort var att bevisa förekomsten av en understruktur av atomer, elektronen, och vidare för att visa att den bara hade en liten del av massan av en atom. Kärnan i en atom innehåller det mesta av sin massa, och kärnans natur var helt oförutsedd.
en annan viktig egenskap hos kvantmekanik började också dyka upp. Alla elektroner är identiska med varandra. Laddning och massa av elektroner är inte medelvärden; snarare är de unika värden som alla elektroner har., Detta gäller för andra grundläggande enheter på submikroskopisk nivå. Alla protoner är identiska med varandra, och så vidare.
kärnan
Här undersöker vi det första direkta beviset på kärnans storlek och massa. I senare kapitel kommer vi att undersöka många andra aspekter av kärnfysik, men den grundläggande informationen om kärnstorlek och massa är så viktig för att förstå atomen som vi anser att den här.
nukleär radioaktivitet upptäcktes 1896, och det var snart föremål för intensiv studie av ett antal av de bästa forskarna i världen., Bland dem var nyzeeländaren Lord Ernest Rutherford, som gjorde många grundläggande upptäckter och fick titeln ”far till kärnfysik.”Född i Nelson, Rutherford gjorde sin forskarutbildning vid Cavendish Laboratories i England innan han tillträdde en tjänst vid McGill University i Kanada där han gjorde det arbete som gav honom ett Nobelpris i kemi 1908. Inom området för atomfysik och kärnfysik finns det mycket överlappning mellan Kemi och fysik, med fysik som ger de grundläggande möjliggörande teorierna., Han återvände till England senare år och hade sex framtida Nobelpristagare som studenter. Rutherford använde kärnstrålning för att direkt undersöka atomkärnans storlek och massa. Experimentet han utarbetade visas i Figur 7. En radioaktiv källa som avger alfastrålning placerades i en blybehållare med ett hål i ena sidan för att producera en stråle av alfa partiklar, som är en typ av joniserande strålning utstötas av kärnorna i en radioaktiv källa., En tunn guldfolie placerades i strålen, och spridningen av alfapartiklarna observerades av glöden de orsakade när de slog en fosforskärm.

Figur 5. Rutherfords experiment gav direkta bevis för kärnans storlek och massa genom att sprida alfapartiklar från en tunn guldfolie. Alfa partiklar med energier på ca 5MeV avges från en radioaktiv källa (som är en liten metallbehållare där en specifik mängd av ett radioaktivt material är förseglat), kollimeras i en stråle och faller på folien., Antalet partiklar som tränger in i folien eller sprider sig till olika vinklar indikerar att guldkärnor är mycket små och innehåller nästan hela guldatomens massa. Detta indikeras särskilt av alfa-partiklarna som sprider sig till mycket stora vinklar, ungefär som en fotboll som studsar på en målvakts Huvud.,
alfapartiklar var kända för att vara de dubbelt laddade positiva kärnorna av heliumatomer som hade kinetiska energier i storleksordningen 5 MeV när de emitterades i kärnförfall, vilket är upplösningen av kärnan i en instabil nuklid genom spontan utsläpp av laddade partiklar. Dessa partiklar interagerar med materia mestadels via Coulomb-kraften, och det sätt på vilket de sprider sig från kärnor kan avslöja kärnans storlek och massa. Detta är analogt med att observera hur en bowlingboll är utspridda av ett objekt som du inte kan se direkt., Eftersom alfapartikelens energi är så stor jämfört med de typiska energierna i samband med atomer (MeV mot eV), skulle du förvänta dig att alfapartiklarna helt enkelt kraschar genom en tunn folie ungefär som en supersonisk bowlingboll skulle krascha genom några dussin rader bowlingpinnar. Thomson hade tänkt sig att atomen skulle vara en liten sfär där lika stora mängder positiv och negativ laddning fördelades jämnt. Den incident massiva alfa partiklar skulle drabbas endast små avböjningar i en sådan modell., Istället, Rutherford och hans medarbetare fann att alfa partiklar ibland var utspridda till stora vinklar, några även tillbaka i den riktning från vilken de kom! Detaljerad analys med bevarande av momentum och energi—särskilt av det lilla numret som kom rakt tillbaka—innebar att guldkärnor är mycket små jämfört med storleken på en guldatom, innehåller nästan hela atomens massa och är tätt bundna. Eftersom guldkärnan är flera gånger mer massiv än alfa-partikeln, skulle en huvudkollision sprida alfa-partikeln rakt tillbaka mot källan., Dessutom, Ju mindre kärnan, desto färre alfa partiklar som skulle slå ett huvud på.
även om resultaten av experimentet publicerades av hans kollegor 1909 tog det Rutherford två år att övertyga sig om deras mening. Liksom Thomson före honom var Rutherford ovillig att acceptera sådana radikala resultat. Naturen i liten skala är så olik vår klassiska värld att även de som ligger i framkant av upptäckten ibland är förvånade. Rutherford skrev senare: ”det var nästan lika otroligt som om du sköt ett 15-tums skal på ett tygpapper och det kom tillbaka och slog dig., På övervägande insåg jag att denna spridning bakåt . . . . . . den största delen av atomens massa koncentrerades i en liten kärna.”
1911 publicerade Rutherford sin analys tillsammans med en föreslagen modell av atomen. Kärnans storlek bestämdes vara ca 10-15 m, eller 100 000 gånger mindre än atomen. Detta innebär en stor densitet, i storleksordningen 1015 g/cm3, till skillnad från alla makroskopiska ämnen. Också underförstådd är förekomsten av tidigare okända kärnkrafter för att motverka de enorma repulsiva Coulomb-krafterna bland de positiva laddningarna i kärnan., Enorma krafter skulle också överensstämma med de stora energierna som emitteras i kärnstrålning.

figur 8. En utökad bild av atomerna i guldfolien i Rutherfords experiment. Cirklar representerar atomerna (ca 10-10 m i diameter), medan prickarna representerar kärnorna (ca 10-15 m i diameter). För att vara synlig är prickarna mycket större än skalan. De flesta alfapartiklar kraschar igenom men är relativt opåverkade på grund av deras höga energi och elektronens lilla massa., Vissa går dock rakt mot en kärna och sprids rakt bakåt. En detaljerad analys ger kärnans storlek och massa.
kärnans lilla storlek innebär också att atomen är mestadels tom inuti. Faktum är att i Rutherfords experiment gick de flesta alphas rakt igenom guldfolien med mycket liten spridning, eftersom elektroner har så små massor och eftersom atomen var mestadels tom med ingenting för att alfaen skulle slå., Det fanns redan tips om detta vid den tiden Rutherford utförde sina experiment, eftersom energiska elektroner hade observerats att penetrera tunna folier lättare än väntat. Figur 8 visar en schematisk av atomerna i en tunn folie med cirklar som representerar atomernas storlek (ca 10-10 m) och prickar som representerar kärnorna. (Prickarna ska inte skala—om de var, skulle du behöva ett mikroskop för att se dem.) De flesta alfapartiklar saknar de små kärnorna och är bara lite utspridda av elektroner., Ibland, (ungefär en gång i 8000 gånger i Rutherfords experiment), träffar en alfa en nucleus head-on och sprids rakt bakåt.

Figur 9. Rutherfords planetariska modell av atomen innehåller egenskaperna hos kärnan, elektronerna och atomens storlek. Denna modell var den första som kände igen atomernas struktur, där lågmasselektroner kretsar en mycket liten, massiv kärna i banor som är mycket större än kärnan. Atomen är mestadels tom och är analog med vårt planetsystem.,
baserat på kärnans storlek och massa avslöjad av hans experiment, liksom massan av elektroner, föreslog Rutherford atomens planetariska modell. Den planetariska modellen av atomen bilder låg massa elektroner kretsar kring en stor-mass kärna. Storleken på elektronbanorna är stora jämfört med kärnans storlek, med mestadels vakuum inuti atomen. Den här bilden är analog med hur lågmassiga planeter i vårt solsystem kretsar kring den stora masssolen på avstånd stora jämfört med solens storlek., I atomen är den attraktiva Coulomb-kraften analog med gravitation i planetsystemet. (Se Figur 9.) Observera att en modell eller mental bild behövs för att förklara experimentella resultat, eftersom atomen är för liten för att observeras direkt med synligt ljus.
Rutherfords planetariska modell av atomen var avgörande för att förstå atomernas egenskaper och deras interaktioner och energier, som vi ska se i de närmaste sektionerna. Det var också en indikation på hur olika natur är från den välbekanta klassiska världen på den lilla kvantmekaniska skalan., Upptäckten av en understruktur för all materia i form av atomer och molekyler togs nu ett steg längre för att avslöja en understruktur av atomer som var enklare än de 92 elementen då kända. Vi har fortsatt att söka efter djupare understrukturer, som de inuti kärnan, med viss framgång. I senare kapitel kommer vi att följa denna strävan i diskussionen om kvarkar och andra elementära partiklar, och vi kommer att titta på den riktning sökningen verkar nu vara på väg.,
Phet Explorations: Rutherford Scattering
hur räknade Rutherford ut atomens struktur utan att kunna se den? Simulera det berömda experimentet där han motbevisade plommonpudding-modellen av atomen genom att observera alfapartiklar som studsar av atomer och bestämmer att de måste ha en liten kärna.
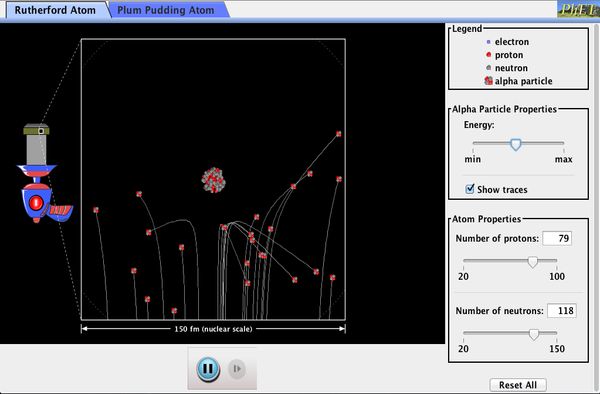
Klicka för att ladda ner simuleringen. Kör med Java.,
avsnitt sammanfattning
problem& övningar
- Rutherford fann storleken på kärnan att vara ca 10-15 m. Detta innebar en stor densitet. Vad skulle denna densitet vara för guld?
- I Millikans oljedroppsexperiment tittar man på en liten oljedroppe som hålls rörlös mellan två plattor. Ta spänningen mellan plattorna för att vara 2033 V, och plattan separationen vara 2,00 cm. Oljedroppen (med densitet 0,81 g / cm3) har en diameter på 4,0 × 10-6 m. hitta laddningen på droppen, när det gäller elektronenheter.,
- (a) en aspirerande fysiker vill bygga en skalmodell av en väteatom för sitt Science fair-Projekt. Om atomen är 1,00 m i diameter, hur stor ska hon försöka göra kärnan? b) hur lätt blir det att göra?