membranproteiner
medan lipider är de grundläggande strukturella elementen i membran, är proteiner ansvariga för att utföra specifika membranfunktioner. De flesta plasmamembran består av cirka 50% lipid och 50% protein i vikt, med kolhydratdelarna av glykolipider och glykoproteiner som utgör 5 till 10% av membranmassan. Eftersom proteiner är mycket större än lipider motsvarar denna procentandel ungefär en proteinmolekyl per var 50 till 100 molekyler av lipid., År 1972 föreslog Jonathan Singer och Garth Nicolson den flytande mosaikmodellen av membranstruktur, som nu är allmänt accepterad som det grundläggande paradigmet för organisationen av alla biologiska membran. I denna modell ses membran som tvådimensionella vätskor i vilka proteiner sätts in i lipidbilager (figur 12.3).

figur 12.3
fluid mosaic modell av plasmamembranet., Integralmembranproteiner sätts in i lipidbilagret, medan perifera proteiner är bundna till membranet indirekt genom protein-proteininteraktioner. De flesta integrerade membranproteiner är transmembrane (mer…)
Singer och Nicolson utmärkte två klasser av membranrelaterade proteiner, som de kallade perifera och integrerade membranproteiner., Perifera membranproteiner definierades operativt som proteiner som skiljer sig från membranet efter behandlingar med polära reagenser, såsom lösningar med extremt pH eller hög saltkoncentration, som inte stör det fosfolipida dubbelskiktet. När dissocierad från membranet är perifera membranproteiner lösliga i vattenhaltiga buffertar. Dessa proteiner sätts inte in i det hydrofoba interiören i lipidbilagret. I stället är de indirekt associerade med membran genom protein-proteininteraktioner., Dessa interaktioner involverar ofta jonbindningar, som störs av extremt pH eller högt salt.
i motsats till de perifera membranproteinerna kan integrerade membranproteiner endast frigöras genom behandlingar som stör fosfolipidbilagret. Delar av dessa integrerade membranproteiner sätts in i lipidbilagret, så att de endast kan dissocieras av reagenser som stör hydrofoba interaktioner., De vanligaste reagenserna för solubilisering av integrerade membranproteiner är tvättmedel, vilka är små amfipatiska molekyler som innehåller både hydrofoba och hydrofila grupper (figur 12.4). De hydrofoba delarna av tvättmedel förskjuter membranlipiderna och binder till de hydrofoba delarna av integrerade membranproteiner. Eftersom den andra änden av tvättmedelsmolekylen är hydrofil, är tvättmedelsproteinkomplexen lösliga i vattenhaltiga lösningar.

figur 12.4
solubilisering av integrerade membranproteiner genom tvättmedel., Rengöringsmedel (t.ex. oktylglukosid) är amfipatiska molekyler som innehåller hydrofila huvudgrupper och hydrofoba svansar. De hydrofoba svansarna binder till de hydrofoba regionerna av integrerat membran (mer…)
många integrerade proteiner är transmembranproteiner, som spänner över lipidskiktet med portioner som exponeras på båda sidor av membranet. Dessa proteiner kan visualiseras i elektronmikrografer av plasmamembran framställda genom frysfrakturtekniken (se figur 1.35). I dessa exemplar delas membranet och separeras i sina två broschyrer., Transmembranproteiner är sedan uppenbara som partiklar på membranets inre ytor (figur 12.5).

figur 12.5
Freeze-fracture electron micrograph of human red blood cell membranes. Partiklarna i membranet är transmembranproteiner. (Harold H. Edwards/Visuella Obegränsad.,)
de membranspännande delarna av transmembranproteiner är vanligtvis α-helicer av 20 till 25 hydrofoba aminosyror som sätts in i membranet i endoplasmatisk retikulum under syntes av polypeptidkedjan (se figurerna 9.11, 9.12 och 9.13). Dessa proteiner transporteras sedan i membranblåsor från endoplasmatisk retikulum till Golgi-apparaten och därifrån till plasmamembranet., Kolhydratgrupper läggs till polypeptidkedjorna i både endoplasmatiska retikulum och Golgi-apparaten, så de flesta transmembranproteiner i plasmamembranet är glykoproteiner med sina oligosackarider exponerade på cellens yta.
studier av röda blodkroppar har gett goda exempel på både perifera och integrerade proteiner associerade med plasmamembranet. Membran av humana erytrocyter innehåller cirka ett dussin huvudproteiner, som ursprungligen identifierades genom gelelektrofores av membranpreparat., De flesta av dessa är perifera membranproteiner som har identifierats som komponenter i det kortikala cytoskelettet, vilket ligger till grund för plasmamembranet och bestämmer cellform (se kapitel 11). Till exempel är det mest rikliga perifera membranproteinet av röda blodkroppar spektrin, vilket är det huvudsakliga cytoskeletala proteinet av erytrocyter. Andra perifera membranproteiner av röda blodkroppar inkluderar aktin, ankyrin och band 4.1., Ankyrin fungerar som den huvudsakliga länken mellan plasmamembranet och cytoskelettet genom bindning till både spektrin och det integrerade membranproteinbandet 3 (Se figur 11.11). En ytterligare länk mellan membranet och cytoskelettet tillhandahålls av band 4.1, som binder till korsningar av spektrin och aktin, liksom till glykoforin (det andra stora integrerade membranproteinet av erytrocyter).
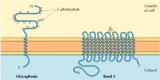
de två viktigaste integrerade membranproteinerna i röda blodkroppar, glycophorin och band 3, ger väl studerade exempel på transmembranproteinstruktur (figur 12.6)., Glycophorin är ett litet glykoprotein av 131 aminosyror, med en molekylvikt på cirka 30 000, varav hälften är protein och halv kolhydrat. Glycophorin korsar membranet med ett enda membran-spännande α-helix av 23 aminosyror, med dess glykosylerade amino-terminala del exponerad på cellytan. Även om glycophorin var ett av de första transmembranproteinerna som ska karakteriseras, är dess exakta funktion fortfarande okänd. Däremot är funktionen hos det andra stora transmembranproteinet av röda blodkroppar väl förstått., Detta protein, ursprungligen känt som band 3, är aniontransportören ansvarig för passage av bikarbonat (HCO3-) och kloridjoner (Cl-) över Röda blodcellsmembranet. Band 3 polypeptidkedjan är 929 aminosyror och tros ha 14 membranspännande α-spiralformade regioner. Inom membranet bildar dimer av band 3 globulära strukturer innehållande inre kanaler genom vilka joner kan resa över lipidbilagret.
figur 12.6
integrerade membranproteiner av röda blodkroppar., Glycophorin (131 aminosyror) innehåller en enda transmembran α-helix. Det är starkt glyokosylerat, med oligosackarider fästa vid 16 platser på den extracellulära delen av polypeptidkedjan. (mer…)
på grund av deras amfipatiska karaktär har transmembranproteiner visat sig vara svåra att kristallisera, vilket krävs för tredimensionell strukturell analys genom röntgendiffraktion., Det första transmembranproteinet som analyserades genom röntgenkristallografi var det fotosyntetiska reaktionscentret för bakterien Rhodopseudomonas viridis, vars struktur rapporterades 1985 (figur 12.7). Reaktionscentret innehåller tre transmembranproteiner, betecknade l, m och H (ljus, medium och tung) enligt deras uppenbara storlekar som indikeras av gelelektrofores. L-och m-subenheterna har var och en fem membranspännande α-spiror. H-subenheten har endast en enda transmembrane α-helix, med huvuddelen av polypeptidkedjan på den cytosoliska sidan av membranet., Den fjärde subenheten i reaktionscentret är ett cytokrom, vilket är ett perifert membranprotein bundet till komplexet genom protein-proteininteraktioner.

figur 12.7
ett bakteriellt fotosyntetiskt reaktionscentrum. Reaktionscentret består av tre transmembranproteiner, betecknade l (Röd), M (gul) och H (grön). L-och M-underenheterna har var och en fem transmembrane α-helices, medan H-underenheten endast har (mer…)
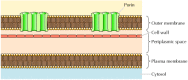
Även om de flesta transmembranproteiner spänner över membranet av α-spiralregioner, är detta inte alltid fallet., Ett väl karakteriserat undantag tillhandahålls av porinerna-en klass av proteiner som bildar kanaler i de yttre membranen hos vissa bakterier. Många bakterier, inklusive E. coli, har ett dubbelt membransystem där plasmamembranet (eller inre membranet) är omgivet av cellväggen och ett distinkt yttre membran (figur 12.8). I motsats till plasmamembranet är det yttre membranet mycket permeabelt för joner och små polära molekyler (i fallet med E. coli, med molekylvikter upp till 600). Denna permeabilitet härrör från porinerna, som bildar öppna vattenhaltiga kanaler genom lipidbilagret., Som diskuterats i kapitel 10 finns proteiner relaterade till bakteriella poriner också i mitokondriernas och kloroplasternas yttre membran.
figur 12.8
bakteriella yttre membran. Plasmamembranet hos vissa bakterier är omgivet av en cellvägg och ett distinkt yttre membran. Det yttre membranet innehåller poriner, som bildar öppna vattenhaltiga kanaler som möjliggör fri passage av joner och små molekyler.
strukturell analys har visat att porinerna inte innehåller hydrofoba α-spiralområden., I stället korsar de membranet som β-fat, där 16 β-ark viks upp i en fatliknande struktur som omsluter en vattenhaltig pore (figur 12.9). Sidokedjorna av polära aminosyror leder porerna, medan sidokedjor av hydrofoba aminosyror interagerar med membranets inre. Porinmonomererna associerar till att bilda stabila trimerer, som var och en innehåller tre öppna kanaler genom vilka polära molekyler kan diffundera över membranet.

figur 12.9
struktur av en porinmonomer., Varje monomer är en β-fat bestående av 16 antiparallel β-strängar (pilar). Molekylens övre ände står inför det yttre mediet. (Från H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
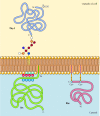
i motsats till transmembranproteiner är en mängd olika proteiner (av vilka många beter sig som integrerade membranproteiner) förankrade i plasmamembranet genom kovalent fastsatta lipider eller glykolipider (figur 12.10). Medlemmar av en klass av dessa proteiner sätts in i plasmamembranets yttre bipacksedel genom glykosylfosfatidylinositol (GPI) ankare., GPI-ankare läggs till vissa proteiner som har överförts till endoplasmatisk retikulum och är förankrade i membranet genom en C-terminal transmembranregion (se figur 9.16). Transmembranregionen klyvs som GPI-ankaret tillsätts, så dessa proteiner förblir fästa vid membranet endast av glykolipiden. Eftersom polypeptidkedjorna av GPI-förankrade proteiner överförs till endoplasmatisk retikulum, är de glykosylerade och exponerade på cellens yta efter transport till plasmamembranet.
Figur 12.,10
exempel på proteiner förankrade i plasmamembranet med lipider och glykolipider. Vissa proteiner (t.ex. lymfocytproteinet Thy-1) är förankrade i plasmamembranets yttre broschyr med GPI-ankare som läggs till deras C-terminus i endoplasmatisk retikulum. (mer…)
andra proteiner är förankrade i plasmamembranets inre bipacksedel genom kovalent fastsatta lipider. I stället för att behandlas genom den sekretoriska vägen syntetiseras dessa proteiner på fria cytosoliska ribosomer och modifieras sedan genom tillsats av lipider., Dessa modifieringar innefattar tillsats av myristinsyra (en 14-kolfettsyra) till aminoterminalen i polypeptidkedjan, tillsats av palmitinsyra (16 kol) till sidokedjorna av cysteinrester och tillsats av prenylgrupper (15 eller 20 kol) till sidokedjorna av karboxiterminala cysteinrester (se figurerna 7.29, 7.30 och 7.31). I vissa fall är dessa proteiner (av vilka många beter sig som perifera membranproteiner) riktade mot plasmamembranet genom positivt laddade regioner i polypeptidkedjan såväl som av de bifogade lipiderna., Dessa positivt laddade proteindomäner kan interagera med de negativt laddade huvudgrupperna av fosfatidylserin på plasmamembranets cytosoliska ansikte. Det är anmärkningsvärt att många av proteinerna förankrade i plasmamembranets inre broschyr (inklusive Src-och Ras-proteinerna som illustreras i Figur 12.10) spelar viktiga roller vid överföring av signaler från cellytreceptorer till intracellulära mål, vilket diskuteras i nästa kapitel.