en titrering är en volymetrisk teknik där en lösning av ett reaktant (titern) tillsätts till en lösning av ett andra reaktant (”analyten”) tills ekvivalenspunkten nås. Ekvivalenspunkten är den punkt där titranten har tillsatts i exakt rätt mängd för att reagera stökiometriskt med analyten (när mol av titrant = mol av analyt). Om antingen titern eller analyten är färgad, är ekvivalenspunkten uppenbar från färgförsvinnandet när reaktanterna konsumeras., Annars kan en indikator läggas till som har en” endpoint ” (ändrar färg) vid ekvivalenspunkten, eller ekvivalenspunkten kan bestämmas från en titreringskurva. Mängden tillsatt titrar bestäms av dess koncentration och volym:
n (mol) = C (mol/L) * V (l)
och mängden Tirant kan användas i den vanliga stökiometriska beräkningen för att bestämma mängden analyt.
titreringsprocessen kan observeras i videon nedan.,
en uppmätt volym av den lösning som ska titreras placeras i en bägare i detta fall färglös vattenhaltig ättiksyra, CH3COOH(aq). Den färglösa natriumhydroxidnaoh (aq), som är titranten, tillsätts noggrant med hjälp av en buret. Den tillsatta titreringsvolymen kan sedan bestämmas genom att man läser vätskenivån i buret före och efter titrering. Denna läsning kan vanligtvis uppskattas till närmaste hundradel av en milliliter, så exakta tillägg av titrant kan göras snabbt.,
eftersom de första milliliterna av titrantflöde i kolven ändras en viss indikator kort till rosa, men återgår till färglös snabbt. Detta beror på ett stort överskott av ättiksyra. Det begränsande reagenset NaOH konsumeras helt.
den tillsatta indikatorn ändras till rosa när titreringen är klar, vilket indikerar att all vattenhaltig ättiksyra har förbrukats av NaOH(aq). Reaktionen som uppstår är
\
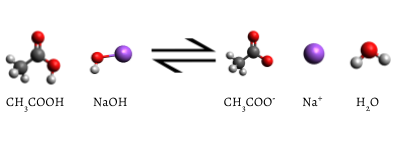
så småningom förbrukas all ättiksyra., Tillsats av även en bråkdel av en droppe titrant ger en bestående rosa färg på grund av oreagerad NaOH i kolven. Färgförändringen som uppstår vid indikatorns slutpunkt signalerar att all ättiksyra har förbrukats, så vi har nått titreringens ekvivalenspunkt. Om något mer NaOH-lösning tillsattes skulle det finnas ett överskott och lösningens färg i kolven skulle bli mycket mörkare. Slutpunkten visas plötsligt, och försiktighet måste vidtas för att inte överskrida slutpunkten.
Efter att titreringen har nått slutpunkten läses en slutlig volym från buret., Med den ursprungliga och slutliga avläsningen kan den volym som läggs till bestämmas ganska exakt:
syftet med en titrering är alltid att lägga till bara den mängd Tirant som behövs för att konsumera exakt den mängd substans som titreras. I NaOH—CH3COOH reaktion Eq. \ (\ref{2}\), ekvivalenspunkten uppstår när en lika molar mängd NaOH har lagts till från den graderade cylindern för varje mol av CH3COOH som ursprungligen fanns i titreringskolven., Det vill säga vid ekvivalenspunkten används förhållandet mellan mängden NaOH, tillsatt till mängden CH3COOH som konsumeras, lika med det stökiometriska förhållandet
\
titrering ofta för att bestämma koncentrationen av en lösning. I många fall är det inte en enkel sak att få en ren substans, väga den noggrant och lösa upp den i en volymetrisk kolv som gjordes i Exempel 1 av Lösningskoncentrationer. NaOH kombinerar till exempel snabbt med H2O och CO2 från luften, och så även ett nyberedd prov av fast NaOH kommer inte att vara rent., Dess vikt skulle förändras kontinuerligt när CO2 (g) och H2O(g) absorberades. Väteklorid (HCL) är en gas vid vanliga temperaturer och tryck, vilket gör det mycket svårt att hantera eller väga. Vattenlösningar av båda dessa ämnen måste standardiseras; det vill säga deras koncentrationer måste bestämmas genom titrering.
den överlägset vanligaste användningen av titreringar är att bestämma okända, det vill säga vid bestämning av koncentrationen eller mängden ämne i ett prov som vi ursprungligen inte visste någonting om. Nästa exempel innebär en okänd som många människor möter varje dag.,
308.0 mg som erhålls i detta exempel är i ganska nära överenskommelse med tillverkarens påstående om 300 mg. Tabletterna stämplas ut av maskiner, inte vägs individuellt, och så förväntas en viss variation.