us Pharm. 2020;45(9):27-29.resumo: desde que as hormonas sintéticas Foram combinadas pela primeira vez na década de 1940, a terapêutica de substituição hormonal tem sido amplamente utilizada por mulheres com sintomas de menopausa indesejáveis. Pesquisas posteriores levaram a descobertas de vários efeitos negativos associados com o uso de terapia hormonal, provocando discussões sobre os riscos versus benefícios do tratamento hormonal., Devido aos riscos associados com as preparações comerciais, a terapia hormonal composta (CHT) tornou-se mais proeminente, uma vez que tem sido apresentada como uma alternativa biologicamente equivalente às hormonas sintéticas. No entanto, por causa da supervisão mínima a nenhuma FDA no domínio da composição em geral, CHT pode não ser tão seguro como foi anunciado. Em 2018, com base em resultados de ensaios favoráveis, Bijuva tornou-se a primeira associação bioidêntica aprovada pela FDA com a formulação 17-beta estradiol-progesterona.,durante décadas, as mulheres recorreram à terapêutica hormonal de substituição para tratar sintomas vasomotores adversos associados à menopausa, tais como afrontamentos e suores nocturnos. As mulheres podem passar até um terço de suas vidas em um estado com deficiência hormonal, o que contribui ainda mais para efeitos indesejáveis como alterações de humor, aumento do risco de osteoporose e diminuição da libido. O estrogénio Sistémico é o tratamento mais eficaz para os sintomas vasomotores, enquanto que os sintomas genitourinários associados à menopausa devem ser tratados com estrogénio tópico de dose baixa.,1 o estudo observacional da saúde das mulheres em todo o país descobriu que as mulheres experimentam sintomas vasomotores por uma média de 7,4 anos após a menopausa.No entanto, a maioria dos médicos aconselha que o tratamento não dure mais de 5 anos após a menopausa e recomenda fortemente evitar a terapia hormonal em mulheres com mais de 60 anos de idade.1 o clínico deve ponderar cuidadosamente os riscos e benefícios associados aos hormônios sintéticos e compostos, tendo em mente o objetivo principal de melhorar a qualidade de vida do paciente.,hormonas Bioidenticais, tais como estrogénios, progestinas e androgénios, são compostos que são preparados de acordo com o Capítulo USP <795> padrões de composição não esterilizada. Estas hormonas podem ser adicionadas em uma variedade de dosagens e formas de dosagem, criando muitas opções para as mulheres interessadas em terapia hormonal agravada (CHT)., Formulações compostas não passam pelo rigoroso teste de padrões de fabricação e pureza que seus homólogos aprovados pela FDA fazem; no entanto, apesar deste ambiente não regulamentado, a CHT é muito popular entre os pacientes que procuram medicamentos mais “personalizados”.
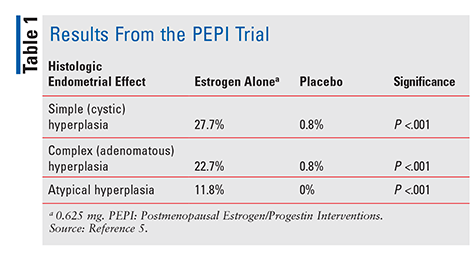
A Sociedade Endócrina definiu hormônios bioidênticos compostos como ” compostos que têm exatamente a mesma estrutura química e molecular que hormônios que são produzidos no corpo humano.,”3 a FDA afirma que o termo hormônio bioidentical é puramente uma estratégia de marketing, uma vez que não há base científica para um benefício implícito ou redução de risco para a TC sobre a terapia hormonal sintética aprovada pelo FDA.O FDA aprovou o dietilestilbestrol em 1941 e os estrogénios equinos conjugados (CEE) em 1942 para tratar sintomas menopáusicos.4 a partir da década de 1960, as vendas de estrogênio subiram até 1975, quando surgiram relatos de que o uso de estrogênio poderia estar associado a um aumento do risco de câncer endometrial.,4 No entanto, estes relatórios foram em grande parte ignorados, e o uso de estrogênio continuou. Só em 1996, quando foi publicado o ensaio de intervenções pós-menopáusicas de estrogénio/progestina (PEPI), é que os prestadores de cuidados de saúde começaram a compreender verdadeiramente os potenciais efeitos negativos associados à terapêutica com estrogénios. O PEPI foi um ensaio multicêntrico, aleatorizado, controlado com placebo, com duração de 3 anos, em dupla ocultação, que examinou os efeitos histológicos do endométrio da terapêutica com estrogénio sintético sem oposição versus três regimes diferentes de estrogénio sintético mais progestina.,5
no ensaio PEPI, significativamente mais indivíduos que receberam estrogénio isoladamente desenvolveram hiperplasia endometrial simples, complexa ou atípica versus indivíduos que receberam placebo (Tabela 1). Além disso, embora as percentagens exactas não tenham sido especificadas, as taxas de hiperplasia em indivíduos aos quais foi administrado um dos três regimes de estrogénio-mais-progestina foram semelhantes às dos indivíduos aos quais foi administrado placebo.Em resumo, a administração de estrogénio em monoterapia numa dose de 0.,625 mg por dia levaram a um aumento significativo da incidência de hiperplasia endometrial, enquanto que a combinação de CEE com progestina protegeu o endométrio de um crescimento excessivo até um grau considerável.Devido a este risco comprovado de cancro do endométrio, a progestina é sempre administrada em combinação com o estrogénio em mulheres com útero intacto. Confirmando ainda este risco, uma série de casos de 2007 descreveu três mulheres que usaram TC contendo doses sub-terapêuticas de progestina e posteriormente desenvolveram câncer endometrial.,6
O PEPI trial, juntamente com os resultados em 16,068 mulheres pós-menopausa da women’s Health Initiative (WHI), publicada em 2002, esclarecer as graves preocupações levantadas na década de 1970.7 Embora o PEPI trial não mostrou aumento do risco de hiperplasia com a combinação de produto, o WHI encontrado aumentou significativamente os riscos associados com hormônio sintético, tais como doença cardiovascular, acidente vascular cerebral, eventos tromboembólicos, e câncer de mama.,Houve um aumento de 80% do risco de doença cardiovascular ao fim de 1 ano após a descontinuação da terapêutica combinada de acetato de CEE/medroxiprogesterona, e um aumento de 37% do risco de acidente vascular cerebral isquémico durante a fase de intervenção com a terapêutica combinada. Além disso, o risco de cancro da mama aumentou significativamente (24%) durante a intervenção. O uso de estrogénio-mais-progestina proporcionou alguns benefícios, com os doentes a notar uma diminuição da incidência de atrofia vaginal, redução dos sintomas vasomotores, tais como afrontamentos e suores nocturnos, e uma diminuição de 38% do risco de cancro colorectal durante o tratamento com terapêutica combinada.,No entanto, devido ao aumento do risco de cancro da mama e de acontecimentos tromboembólicos, o ensaio foi interrompido precocemente.
Agravado Terapia Hormonal
Os riscos discutidos acima, abriu o caminho para o CHT de advocacia, porque pensava-se que a adaptação ou personalização da CHT para o paciente individual maximizar o benefício e minimizar o risco. Alegações de que CHT era mais seguro e biologicamente mais amigável tornou-se mais proeminente, e seu uso aumentou., Pinkerton e Santoro usaram duas pesquisas diferentes-Harris e Rose—para avaliar o conhecimento dos pacientes sobre CHT e quantificar o uso de CHT versus a terapia hormonal aprovada pela FDA, respectivamente.8 os resultados da pesquisa Harris indicaram que 86% das mulheres com idades entre 40 e 65 anos não sabiam que a CHT não foi aprovada pela FDA, e os resultados extrapolados da pesquisa Rose sugeriram que, anualmente, até 2,5 milhões de mulheres com mais de 40 anos podem usar CHT.Dados de ambos os inquéritos indicaram que um médico ou farmacêutico tinha recomendado CHT., Estes resultados sugerem que existe a oportunidade para provedores de modo a garantir que os pacientes são informados sobre o produto que eles estão recebendo, incluindo todos os possíveis riscos associados com a terapia hormonal, e para compostos farmacêuticos para garantir que eles estão oferecendo uma terapêutica do produto puro que os pacientes podem confiar.como a FDA não é responsável pela padronização de produtos compostos, a regulamentação muitas vezes recai sobre os conselhos estatais da farmácia., Estes conselhos normalmente não têm recursos para realizar inspeções regulares de farmácias de composição, e a FDA intervém apenas quando uma queixa é feita.Apesar de formulações compostas não serem legalmente necessárias para transportar advertências de risco, teoricamente estes produtos podem apresentar os mesmos riscos que os acima mencionados para a terapia hormonal sintética. No entanto, até à data, não se realizaram ensaios de segurança cabeça-a-cabeça de CHT versus hormonas sintéticas.,10
Existem três tipos de estrógenos uma mulher pode receber, como parte de um composto hormonal de substituição, regime: estrona (E1), estradiol (E2) e estriol (E3), cada um com um grau variável de potência (E2 > E1 > E3).Devido ao facto de competirem pelo mesmo receptor, estes estrogénios actuam como inibidores competitivos, resultando numa eficácia diminuída se não forem equilibrados correctamente.,Consequentemente, os proponentes da CHT desenvolveram Biest (E2 + E3 em uma formulação de 20/80) e Triest (E1 + E2 + E3 em uma formulação de 10/10/80), a fim de maximizar a potência fisiológica, mas atualmente não há evidência para apoiar a alegação de que estas formulações nestas razões conferem qualquer benefício de segurança em comparação com a terapia hormonal sintética.11
Embora em todo o CHT tem sido inadequadamente estudados e não regulamentada, em outubro de 2018, com base nas descobertas da REABASTECER julgamento, Bijuva tornou-se o primeiro aprovado pelo FDA bioidentical combinação de 17-beta estradiol-progesterona formulação., O REPLENISH, um estudo multicêntrico, aleatorizado, em dupla ocultação, controlado com placebo, investigou a eficácia, a segurança endometrial e a segurança global de quatro dosagens diferentes de uma cápsula única de 17-beta estradiol-progesterona para sintomas vasomotores moderados a graves em mulheres pós-menopáusicas.O objectivo primário de segurança foi a incidência de hiperplasia do endométrio aos 12 meses. Aos 12 meses, não se observaram casos de hiperplasia do endométrio para qualquer das formulações posológicas de estradiol-progesterona.,12 às 12 semanas, a formulação de 100 mg de estradiol 1 mg–progesterona demonstrou a maior redução estatisticamente significativa na frequência e gravidade dos sintomas vasomotores comparativamente com o placebo, mantendo ao mesmo tempo os padrões primários de avaliação final de segurança.No entanto, como mencionado anteriormente, não houve ensaios comparativos entre a segurança das hormonas sintéticas e as formulações de hormonas bioidenticas, pelo que, teoricamente, os riscos permanecem.,
Conclusion
Based on the REPLENISH trial, pre-, peri-, and postmenopausal women now have a standardized, regulated, bioidentical, FDA-approved treatment for vasomotor symptoms. São necessários ensaios futuros para delinear completamente o perfil de segurança de 17-beta estradiol e CHT. Os farmacêuticos devem recomendar qualquer formulação de hormona oral durante o período mais curto possível., Além disso, se a CHT for escolhida, os farmacêuticos devem garantir que os seus doentes saibam o que é CHT e como difere das hormonas sintéticas, tendo também uma conversa franca sobre os benefícios e riscos da terapia de substituição de hormonas.1. Martin KA, Manson JE. Abordagem ao paciente com sintomas de menopausa. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Duração dos sintomas vasomotores da menopausa durante a transição da menopausa. Jama Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et al., Somed bioidentical hormones in endocrinology practice: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Estrogénios e progestinas: antecedentes e história, tendências do consumo e orientações e regimes aprovados pela Food and Drug Administration dos EUA. Am J Med. 2005; 118(suppl 12B): 64-73.
5. Grupo de escrita para o julgamento PEPI. Efeitos da terapêutica hormonal de substituição na histologia do endométrio em mulheres pós-menopáusicas. O ensaio de intervenções pós-menopáusicas de estrogénio/progestina (PEPI). JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. três casos de cancro endometrial associado com terapia de substituição hormonal” bioidentical”. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Riscos e benefícios do estrogénio e da progestina em mulheres pós-menopáusicas saudáveis: principais resultados da iniciativa de Saúde Das Mulheres ensaio controlado aleatorizado. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. somou a terapia hormonal bioidentical: identificando tendências de uso e lacunas de conhecimento entre as mulheres norte-americanas. Menopausa. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Equívoco e preocupações sobre as hormonas bioidenticas utilizadas para a terapia hormonal de composição personalizada. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Folheto informativo Bijuva (estradiol e progesterona). Boca Raton, FL: TherapeuticsMD, Inc; novembro de 2019.
11. Kuhl H. Farmacologia dos estrogénios e progestogénios: influência de diferentes vias de administração. Climaterio. 2005; 8(suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et al. Uma cápsula oral de 17beta-estradiol-progesterona para sintomas vasomotores em mulheres pós-menopáusicas: um ensaio controlado aleatorizado. Obstet Gynecol., 2018;132(1):161-170.o conteúdo deste artigo destina-se apenas a fins informativos. O conteúdo não se destina a substituir o aconselhamento profissional. A confiança em qualquer informação fornecida neste artigo é apenas por sua conta e risco.