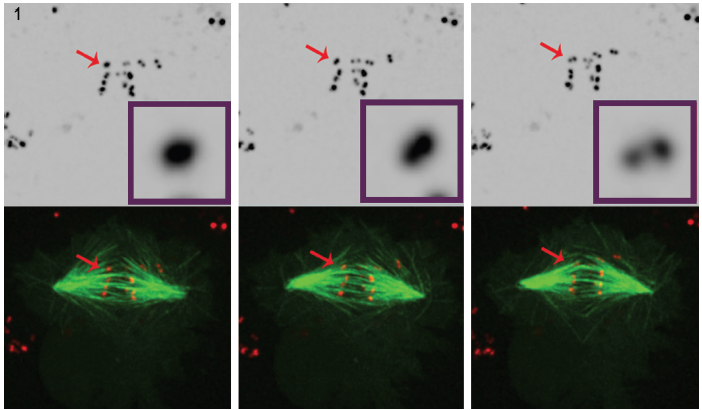
Figura 1. Três imagens Selecionadas a partir de um filme de POLO-esgotado células mostram claramente que, ao longo do tempo, intenso centrômero/kinetochore sinal (vermelho) resolve em um par de pontos, o que demonstra que os cromossomas são syntelically ligados aos microtúbulos do fuso (verde). Foram recolhidos dados de microscopia de fluorescência 4D a cada 30 segundos com 0.,5 mm Z-passos que cobrem todo o volume celular usando um objetivo plan-apocromático de 100°, 1,4 NA a 25 ° C com a unidade confocal de disco giratório de Andor e a câmera EMCCD da iXon, ambos impulsionados por software de imagem de células vivas Andor IQ.
A Divisão de células mitóticas depende da capacidade das células para distribuir adequadamente cromatídeos irmãos em células formadoras. Para executar de forma fiável a função, as células utilizam mecanismos internos de edição para corrigir ligações de fibra cromossómica / Fuso imprecisas., Os cinetóforos emparelhados são geralmente alinhados para anexar adequadamente fibras de fuso e segregar cromatina, no entanto, os kinetóforos errôneos e desalinhados resultam. As células contêm mecanismos de edição especializados para prevenir e corrigir esses pares cinetocoros mal alinhados, embora o mecanismo exato não seja bem compreendido 1,2 ., É postulado por Tatiana Moutinho-Santos na Universidade do Porto, Instituto de Biologia Molecular e Celular de Portugal (IBMC) que a presença de POLO cinase é necessária para promover a bi-orientação cromossómica (designada por arranjo anfitélico) e assim preservar o alinhamento cinetócleo adequado.para compreender melhor o seu papel na regulação do desenvolvimento de kinetocore, o Dr. Moutinho dos Santos estudou a Drosophila POLO kinase esgotada dentro das células vivas para substanciar o envolvimento do POLO nas funções de edição necessárias para manter o arranjo de cinetocore anfitélico., Neste caso, foi estudado o arranjo sintélico (irmãos cinetóforos ligados a microtúbulos que emanam do mesmo fuso). A análise Timelapse da mitose foi realizada nas células de Drosophila S2, expressando de forma estável CID-mCherry para visualização das centrómeros, e GFP-a-tubulina para os microtúbulos. A visualização dos cinetóforos é exigente devido ao seu pequeno tamanho, baixo sinal fluorescente e breve aparência durante a divisão celular. Microscopia de fluorescência Confocal é frequentemente usada para visualizar cinetóforos, no entanto, mesmo neste ambiente, a visualização permanece difícil., Os cinetóforos são muito pequenos (300 nm)3, Perto das capacidades de resolução lateral do microscópio de luz, e excedem a capacidade de resolução axial do microscópio. Além disso, a imagiologia dos marcadores fluorescentes nas células vivas apresenta potenciais efeitos fototóxicos e fotobleaching. A intensa iluminação a laser pode criar problemas de fototoxicidade, especialmente prejudiciais para as células vivas que dividem.a microscopia confocal do disco giratório xD de Andor é utilizada para superar o desafio único do Dr. Moutinho dos Santo associado à observação dos cinetóforos., Neste caso, quatro fatores devem ser abordados simultaneamente para visualizar adequadamente a dinâmica de processos celulares:
- Velocidade de aquisição
- Espacial e temporal a resolução de capacidade
- A capacidade de detecção de muito baixa intensidade de fluorescência níveis
- Gestão do disponível fluorescência sinal
Estes temas espaciais, temporal e de intensidade de resolução freqüente com microscopia de fluorescência e são, muitas vezes em desacordo com experimentos envolvendo a observação da viabilidade celular., Por exemplo, exposições longas de câmeras e longos períodos de iluminação de alta intensidade geram os efeitos fototóxicos que danificam ou destroem células vivas. Simultaneamente, microestruturas ligeiramente rotuladas exigem uma maior exposição à visualização, mas podem ser negativamente afetadas pelo fotobleaching. Complicar a questão é a necessidade de combinar dados tridimensionais tradicionais com o do tempo. Por último, continua a ser necessário discernir o sinal do ruído de fundo e da névoa fora de foco.a velocidade de aquisição é de particular importância para o Dr. Mountinho dos Santos., As células S2 de controlo apresentam um ciclo de divisão de aproximadamente 30 minutos. No entanto, o POLO esgotou células S2 utilizadas em suas experiências mostrou um período de detenção superior a oito horas. A gravação da Divisão de células empobrecidas do POLO requer uma coleção de 7.200 a 12.000 conjuntos de imagens (dois fluorocromos imaginados a cada trinta segundos por uma a cinco horas, adquiridos a 0,5 mícron passos axiais a até 20 passos para a resolução axial do kinetocoro)., A microscopia de fluorescência convencional e a iluminação laser não permitirão nem os requisitos de iluminação suave necessários nem a velocidade de aquisição para completar esta tarefa sensível ao tempo. Por exemplo, a raspagem a laser em microscopia confocal tradicional requer períodos de tempo mais longos para recolher o sinal da amostra. Sistemas confocais de disco giratório são usados para superar essas barreiras tradicionais e para revelar novas percepções sobre técnicas de edição de cinetocore molecular.,a resolução espacial de um disco de fiação confocal é superior nas dimensões lateral (x e y) e axial (z). Através da varredura constante do array pinhole, as amostras podem ser vistas em tempo real em alto contraste, fornecendo imagens claras nos limites de difração da óptica do microscópio. Isto permite a visualização 3D e a compreensão do comportamento cinetócoro dinâmico em relação aos microtúbulos do fuso., Resolução lateral de 300nm e resolução de fibra de fuso de 300-500 nm foram relatados e são detalhados na Figura A.
resolução de intensidade
visualizando os cinetocores fluorescentemente rotulados associados a cada centromere coloca exigências adicionais sobre o sistema de aquisição. Os centrómeros e cinetóforos em estudo são principalmente visíveis apenas durante a interfase da divisão celular. À medida que as células passam pela profase, os centrômeros já se resolveram em 12 pares cromossômicos típicos de Drosophila., A gestão do orçamento de luz disponível durante uma aquisição prolongada requer iluminação suave e alta resolução capaz de rodar técnicas de disco. As aberturas dentro da unidade de disco giratório fornecem estes benefícios. Como a luz excita fluoróforos apenas quando uma abertura está presente, os efeitos fototóxicos são minimizados. Enquanto contraintuitivo, um orçamento reduzido de luz não indica objetos fracos, difíceis de detectar. A resolução de intensidade é aumentada através da exclusão do disco de fiação do sinal fora de foco e subsequente amplificação do sinal por uma arquitetura de câmera EMCCD., Isso cria a nova possibilidade de gerar imagens de maior contraste revelando o desenvolvimento e alinhamento de objetos pontuados, como os kinetocores.
Conclusions
The use of spinning disk technology in Dr. Mountinho dos Santos live cell application led to an important observation. Na ausência do POLO kinase, as células de Drosophila mostraram não dispor dos mecanismos corretivos necessários para manter o arranjo do cromossoma anfitélico., A presença de POLO foi mostrada para fornecer o ambiente certo para a correta arquitetura centromere, garantindo simultaneamente uma boa orientação cromossômica. Células drosófilas cultivadas submetidas a mitose na ausência de cromossomas POLO cinase ligam-se a fibras de fuso com orientação sintélica, isto é, com cinetóforos irmãos ligados a microtúbulos que vêm de um único pólo Fuso.esta conclusão foi obtida através de uma análise cuidadosa do microscópio de fluorescência 4D em células que expressam marcadores de centrómero/ cinetóforo com marcação fluorescente e microtúbulos. (Figura 1).